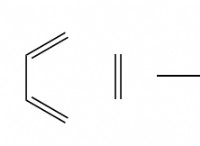
2 C₃H 2 (g) + 9 o₂ (g) → 6 Co₂ (g) + 6 H₂O (g)
엔트로피 이해
엔트로피는 시스템에서 장애 또는 무작위성의 척도입니다. 화학 반응에 적용되는 방법은 다음과 같습니다.
* 장애 증가 =엔트로피 증가 : 더 큰 분자 또는 분자를 생성하는 반응 (가스와 같은)은 일반적으로 긍정적 인 엔트로피 변화를 갖는다 (ΔS> 0).
* 감소 장애 =엔트로피 감소 : 분자가 적거나 더 제한된 움직임 (고체와 같은)을 초래하는 반응은 일반적으로 음성 엔트로피 변화 (ΔS <0)를 갖는다.
반응 분석
* 반응물 : 우리는 총 11 몰의 가스가있는 2 몰의 c₃H₆ 및 9 몰의 O₂로 시작합니다.
* 제품 : 우리는 총 12 몰의 가스가있는 6 몰의 CO₂ 및 6 몰의 HATER로 끝납니다.
주요 관찰 :
* 더 많은 두더지의 가스 : 가스 분자의 수는 11에서 12로 증가합니다. 이것은 장애가 증가하여 긍정적 인 엔트로피 변화를 초래합니다.
* 유사한 분자 복잡성 : 반응물과 제품 모두 비교적 단순한 분자를 포함합니다. 이 요인은 엔트로피 변경에 크게 기여하지 않습니다.
결론
반응 2 c bh₆ (g) + 9 o₂ (g) → 6 co₂ (g) + 6 h₂o (g)는 양의 엔트로피 변화 (ΔS> 0)를 갖는다. 이는 주로 가스 분자 수의 증가 때문입니다.
중요한 참고 : 이 분석은 일반적인 추세를 기반으로하며 엔트로피 변화에 대한 정확한 정량적 값을 제공하지 않습니다. 보다 정확한 결정은 각 반응물 및 생성물에 대해 표준 어금니 엔트로피 값을 사용해야합니다.