핵심 개념
이 유기 화학 튜토리얼에서는 제품 및 반응물의 화학, 메커니즘, 조정 성 및 몇 가지 중요한 반응 변형을 포함한 Diels-Alder 반응의 기본 사항을 배울 것입니다.
.Diels-Alder Reactants 및 제품
Diels-Alder 반응은 2 개의 작은 탄소 구조로부터 6- 탄소 사이클로 알칸을 형성한다. 구체적으로, 2 개의 반응물을 Diene 및 dienophile이라고합니다. 가장 간단한 Diels-Alder 반응은 1,3- 부타디엔 및 Ethene을 사용합니다.
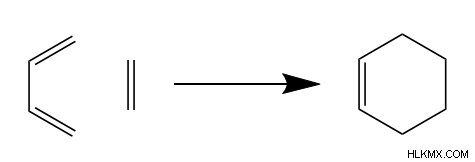
2 개의 이중 결합으로 인해 화학자들이 소위로 제공하는 Diene은 6 개의 탄수화물 중 4 개를 주기적 제품에 공급합니다. 흥미롭게도, Diene의 두 이중 결합은 Dienophile과 반응하기 위해 서로 CIS 여야하며, 이중 결합의 PI 전자가 콘서트에서 움직여야 함을 의미합니다. 이 공동 운동은 우리가 곧 볼 수 있듯이 Diels-Alder의 메커니즘에 중요한 역할을합니다. Diene과의 반응성으로 인해 소위 Dienophile은 두 개의 탄소를 제품에 공급하고 그러한 탄소 사이에 이중 결합 을가집니다.
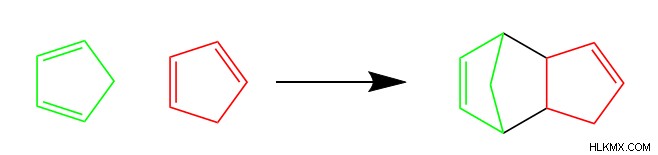
주기적 생성물 구조를 구성하는 6 개의 탄소 외에도 Diene 및 Dienophile은 다양한 구조를 가질 수 있으며 여전히 딜스 경작 반응을 겪을 수 있습니다. 실제로, 분자는 사이클로 펜타 디엔과 함께 아래에 도시 된 바와 같이 디엔과 디엔 포블로 작용할 수있다.
Diels-Alder 반응 메커니즘
먼저, Diene과 dienophile은 dienophile의 각 탄소를 Diene의 탄소 1 및 4와 정렬하는 특정 방향과 상호 작용해야합니다. 다음으로, 벤젠-유사 전이 상태는 전자의 원형 운동을 포함하여 반응물 사이에 2 개의 시그마 결합을 형성한다. 또한, PI 결합은 Diene의 Carbons 2와 3 사이에 형성됩니다. 이것은 주기적 6- 탄소 제품을 생성합니다.
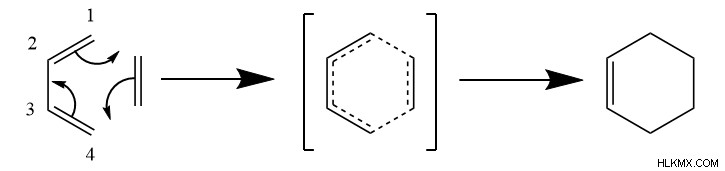
우리가 볼 수 있듯이, 반응은 2 개의 PI 결합이 깨졌고 2 개의 시그마 결합이 형성되었다. 시그마 결합은 PI 결합보다 에너지가 낮기 때문에, 이는 딜스 경고 반응이 발열임을 의미합니다. 그러나, 반응은 또한 엔트로피에서 음성 변화를 가졌다. 일반적으로 두 개의 반응물로부터 하나의 생성물만이 형성되기 때문이다. 열역학적으로, 이것은 엔탈피가 딜스 경고 반응을 유도한다는 것을 의미합니다.
동역적으로, 전이 상태 형성에 필요한 반응물의 정확한 위치로 인해 Diels-Alder는 천천히 진행되는 경향이있다. 이로 인해 전이 상태 형성의 엔트로피에서 매우 부정적인 변화가 발생합니다.
위에서 볼 수 있듯이, Diels-Alder는 산 또는 염기성 촉매가 필요하지 않으며, 이는 반응에 대한 다양한 비 배간 pH 조건이 허용됨을 의미한다.
.Diels-Alder Reaction regioselectivity
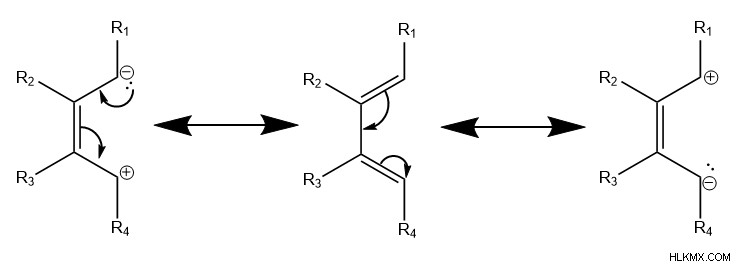
위의 일반적인 메커니즘은 dienophile이 Diene에 비해 위치를 가질 수 있고, 하나의 탄소가 Diene에서 탄소 1과 결합하고 다른 탄소는 4와 상호 작용하는 한, Diene 또는 dienophile이 meso 화합물 일 때 사실입니다 (즉, 반응물 중 하나가 대칭 일 때).
.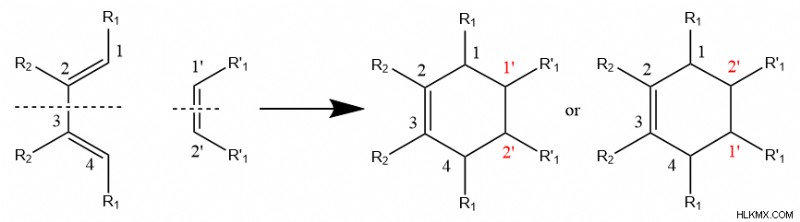
그러나, diene 및 dienophile에 대칭이 부족할 때, 반응은 다른 반응물의 특정 영역이 다른 반응성을 갖는 반응성을 갖는 반응성의 특정 영역에 비해 Diene의 특정 방향을 선호한다. 화학자들은이 현상을“regiosexectivity”라고 부릅니다.
Diene 및 Dienophile에서, 아민과 같은 전자가 풍부한 그룹 또는 카르 복실 산과 같은 전자 그룹의 배치는 분자의 공명 형태에 영향을 미칩니다. 이 공명 형태는 분자 끝에있는 탄소에 부분 양성 또는 음전하를 배치합니다.
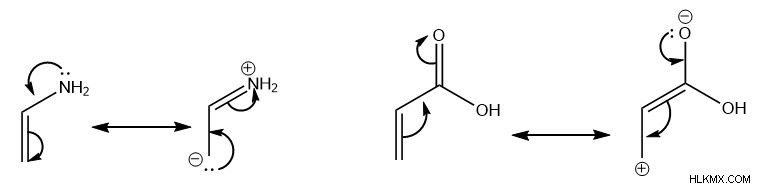

구체적으로, 분자의 전자 분포의 이러한 변화는 지역 반응성에 영향을 미치며, 결과적으로 다른 제품을 선호합니다. PI 전자가 딜스-경고 반응을 겪기 위해 주기적으로 움직이는 것을 더 잘 허용하기 위해, diene 호의에서 부분적으로 양의 탄소는 dienophile의 더 부정적인 탄소를 가진 시그마 결합을 형성하고 그 반대도 마찬가지입니다.
.비슷한 그룹을 가진 Diels-Alder
흥미롭게도, 두 반응물 모두 하나의 전자가 풍부한 또는 하나의 전자가 부족한 그룹을 가질 때, 반응은 meta 을 선호합니다. 제품. 메타 ,이 맥락에서, 그룹은 서로 두 개의 탄소를 서로 멀리 떨어 뜨립니다.
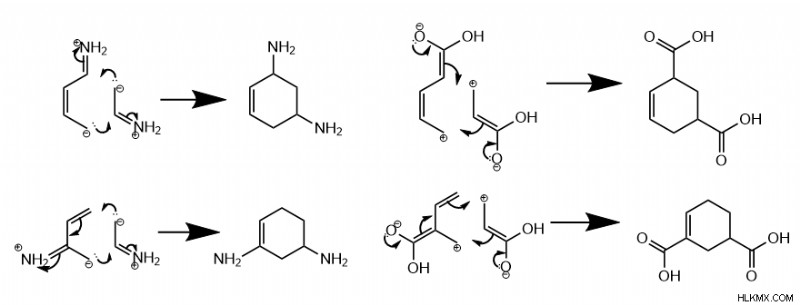
다른 그룹을 가진 Diels-Alder
또한, 한 분자는 전자가 풍부한 그룹을 갖는 반면 다른 분자는 전자 가성 그룹을 가질 때 반응은 para 을 선호합니다. 그룹이 반대로 배치되는 제품 또는 ortho 그룹이 인접하게 배치되는 제품. para 의 형성 대 ortho 제품은 Diene 그룹이 외부 탄소 (1 또는 4) 또는 내부 탄소 (2 또는 3)에서 위치하는지 여부에 따라 다릅니다.
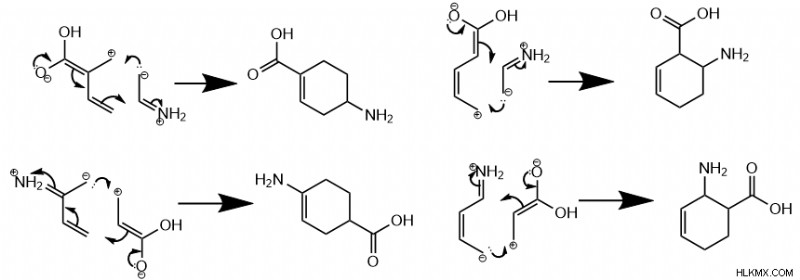
다수의 부착 된 그룹을 갖는 디엔과 디엔 노피의 경우, 딜스 알더의 regiosexectivity는 분자의 공명 형태에 달려있다.
대체 Diels-Alder 반응
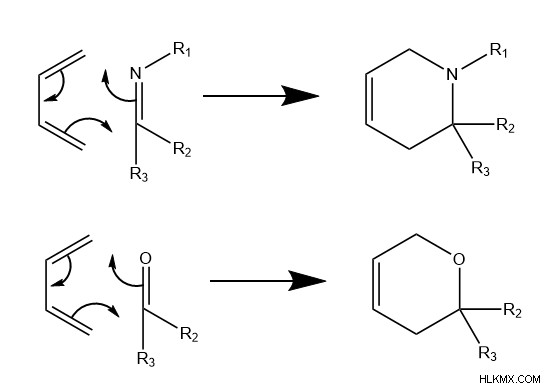
1928 년 독일 화학자 인 오토 딜스 (Otto Diels)와 커트 앨더 (Kurt Alder)에 의해 딜스 알더 반응이 발견 된 이후,이 메커니즘은 이후 화학자들에게 다재다능한 것으로 입증되었습니다. 결과적으로, 나중에 화학자들은 Diels-Alder의 많은 변형을 설명하고 구현했습니다. 일부 예는 비 탄소 원자를 고리 부재로서 이종 세포 분자의 형성을 포함하며, 화학자들은 IMINE-DIELS-ALDER (IDA) 또는 OXO-DIELS-ALDER (ODA) 반응을 사용합니다.
.
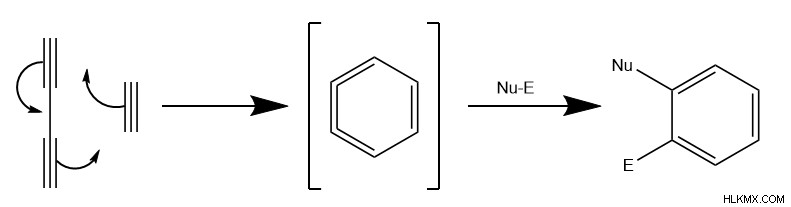
HDDA (Hexadeydro-Diels-Alder 반응)는 이중 결합 대신, 반응물 분자는 삼중 결합을 갖는 또 다른 공통 변이를 나타냅니다. 이 메커니즘은 전자의 동일한 주기적 움직임을 따르며 화학자들이 Benzyne 중간체라고 부르는 것을 형성합니다. 이어서, 친 핵성 및 전자 성분 둘 다를 갖는 화합물은 최종 트리플 결합에 걸쳐 추가 반응을 수행한다. 결과적으로, HDDA는 방향족 분자를 형성한다. 그러나 메커니즘의 독특한 분자 형상으로 인해 반응은 종종 전이 금속 촉매를 필요로합니다.