* 질량 보존 : 화학 방정식의 균형을 잡는 기본 원칙은 질량 보존 법칙입니다. 이 법은 화학 반응에서 물질을 만들거나 파괴 할 수 없다고 명시합니다. 반응물의 총 질량 (반응을 시작하는 물질)은 생성물의 총 질량 (반응에 의해 형성된 물질)과 동일해야합니다.
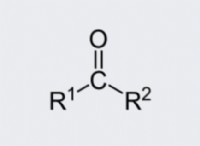
* 원자를 나타내는 : 화학적 공식은 분자에서 원자의 유형과 수를 나타냅니다. 예를 들어, h represO는 2 개의 수소 원자와 하나의 산소 원자를 함유하는 하나의 물 분자를 나타냅니다.
* 분자 수 변경 : 화학적 공식 앞에서 계수를 바꾸면 화학식 자체가 바뀌지 않습니다. 대신, 그것은 분자의 수를 변경합니다 반응에 관여하는 물질의. 예를 들어, 2H₂O는 두 분자의 물을 의미합니다.
작동 방식은 다음과 같습니다.
1. 불균형 방정식으로 시작하십시오 : 이 방정식은 반응물과 생성물을 보여 주지만 양쪽에 올바른 수의 원자가 없습니다.
2. 계수 조정 : 화학 공식 앞에서 계수를 변경하면 방정식의 양쪽에 각 요소의 원자 수를 조정합니다.
3. 원자의 균형 : 반응물 측면과 생성물 측면에서 각 원소의 동일한 수의 원자를 갖는 것을 목표로합니다.
예 :
불균형 방정식 : h₂ + o→ → h₂o
균형 방정식 : 2H→ + o → 2H₂O
균형 방정식에서 계수를 조정했습니다.
* 2 H reac 앞에서 (반응물)
* 2 h (o 앞에서 (제품)
이것은 방정식의 양쪽에 4 개의 수소 원자와 2 개의 산소 원자가 있음을 보장하여 질량 보존 법칙을 유지합니다.
요약 : 화학 방정식의 계수는 방정식의 균형을 유지하는 데 필수적이며, 이는 화학 반응에서 질량 보존의 원리를 반영하여 각 요소의 원자 수가 양쪽에서 동일하도록 보장합니다.