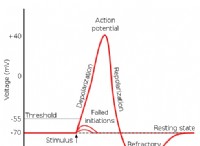
균형 잡힌 산화 환원 반응은 다음과 같습니다.
2mno 2 (aq) + 10Cl⁻ (aq) + 16h⁺ (aq) → 2mn² (aq) + 5Cl (g) + 8h₂o (l)
설명 :
* 산화 : 클로라이드 이온 (CL)은 염소 가스 (CL₂)로 산화됩니다. 각 염화물 이온은 염소 가스를 형성하기 위해 하나의 전자를 잃게됩니다.
* 감소 : 과망간산염 이온 (mno₄⁻)은 망간 (II) 이온 (Mn²⁺)으로 감소된다. 각각의 과망간산염 이온은 5 개의 전자를 얻고 산화 상태는 +7에서 +2로 변합니다.
* 산성 배지 : 반응은 과망간산염 이온의 환원 및 물의 형성에 필요한 양성자를 제공하기 위해 산성 배지 (H⁺)가 필요하다.
조건 :
* 산성 용액 : 반응은 희석 황산과 같은 산성 용액에서 쉽게 진행된다.
* 농도 : 반응물의 농도는 반응 속도에서 역할을한다. 더 높은 농도는 일반적으로 더 빠른 반응을 초래합니다.
* 온도 : 반응 속도는 온도에 따라 증가합니다.
관찰 :
* 이온이 이온이 감소함에 따라 솔루션은 보라색 (mno₄⁻)에서 무색 (mn²)로 변합니다.
* 염소 가스 (CL)의 특징적인 매운 악취가 관찰됩니다.
참고 : 이 반응은 강한 산화제 (과망간가)가 약한 산화제 (염화물)를 산화시키는 산화 환원 반응의 전형적인 예이다.