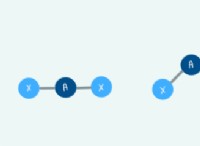
반응
C2H5OH (에탄올) + H2SO4 (황산) → C2H4 (에틸렌) + H2O (물)
메커니즘
1. 에탄올의 양성자 화 : 황산은 강산으로서 작용하여 에탄올의 히드 록실기 (-OH)를 양성한다. 이것은 좋은 떠나는 그룹 인 물 (H2O)을 만듭니다.
2. 탄수화의 형성 : 양성자 화 된 에탄올 분자는 물을 잃고 탄수화물을 형성한다 (양전하의 탄소 원자). 이 경우, 탄수화물은 에틸 탄수화물 (CH3CH2+)입니다.
3. 양성자 제거 : 양성자 (H+)는 탄수화물에 인접한 탄소 원자에서 제거되어 이중 결합의 형성 및 에틸렌의 방출로 이어진다.
조건
* 온도 : 반응은 일반적으로 약 170 ℃의 고온을 필요로한다. 이것은 탈수 과정을 촉진합니다.
황산의 * 농도 : 반응이 효과적으로 진행되는 것을 보장하기 위해 황산의 농축 용액이 사용된다.
* 추가 비율 : 반응이 발열되고 상당한 열을 발생시킬 수 있기 때문에 에탄올은 황산에 천천히 첨가된다.
중요한 메모 :
* 부작용 : 더 높은 온도에서, 다른 부작용이 발생하여 디 에틸 에테르 (C2H5OC2H5)가 형성 될 수있다.
* 산업 공정 : 이 반응은 산업적으로 사용되어 석유 화학 산업의 주요 빌딩 블록 인 대량의 에틸렌을 생산합니다.
전반적으로, 반응은 에탄올로부터의 물 분자를 제거하여 에틸렌과 물의 형성을 초래한다. 이 과정은 황산의 강한 산성 특성과 고온 조건에 의해 구동됩니다.