화합물 이해
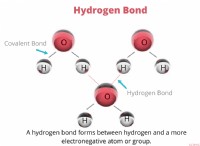
* na₂s 이온 성 화합물 인 황화 나트륨을 나타냅니다.
* 이온 성 화합물 : 이들 화합물은 양으로 하전 된 이온 (양이온)과 음의 하전 이온 (음이온) 사이의 정전기 인력에 의해 형성된다.
다이어그램 그리기
1. 나트륨 이온 (na⁺) :
* 나트륨 (NA)은 하나의 전자를 잃어 긍정적으로 하전 된 이온 (Na⁺)이됩니다.
* 이온은 내부 "+"기호가있는 작은 원으로 나타납니다.
2. 설파이드 이온 (s²⁻) :
* 황 (S)은 2 개의 전자를 얻기 위해 음으로 하전 된 이온 (S²⁻)이됩니다.
* 내부 "2-"기호가있는 더 큰 원으로 s² ions 이온을 나타냅니다.
3. 비율 :
* 포뮬러 Na로는 하나의 황화물 이온마다 두 개의 나트륨 이온이 있다고 알려줍니다.
다이어그램
다이어그램이 표시됩니다.
* "+"표지판이있는 두 개의 작은 원 (NA 이온을 나타냄)
* "2-"표시가있는 하나의 더 큰 원 (s²⁻ 이온을 나타냄)
중요한 메모 :
* 이온 사이의 실제 거리는 종이에 그릴 수있는 것보다 훨씬 큽니다.
* 다이어그램은 단순화입니다. 그것은 결정 격자에서 이온의 정확한 배열을 보여주지 않습니다.
예 (단순화 된 표현)
```
+ +
Na na
2-
에스
```
추가 정보
NAIS의 실제 결정 구조를 나타내려면 3 차원 격자로 배열 된 이온을 보여주는보다 복잡한 다이어그램이 필요합니다. 이것은 간단한 입자 다이어그램의 범위를 벗어납니다.