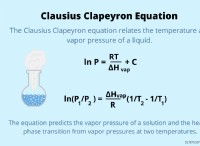
1. 전자 구성 :
* 궤도 : 전자는 궤도라고 불리는 핵 주위의 특정 공간 영역에 존재합니다. 각 궤도에는 고유 한 모양과 에너지 수준이 있습니다.
* 쉘 및 서브 쉘 : 궤도는 쉘 (에너지 레벨) 및 서브 쉘 (쉘 내의 궤도 유형)으로 그룹화됩니다. 예를 들어, 첫 번째 쉘에는 s 서브 쉘 만 있고 두 번째 쉘에는 s 및 p 서브 쉘이 있습니다.
* 충전 순서 : 전자는 특정 규칙에 따라 궤도를 채 웁니다 (Aufbau 원칙, Hund 's Rule, Pauli 배제 원칙). 이 충전 순서는 전자의 배열과 원자의 전체 모양을 지시합니다.
2. 전자-전자 반발 :
* 원자가 전자 : 원자가 전자라고 불리는 가장 바깥 쪽 쉘의 전자는 화학 결합을 담당하며 원자의 모양에 영향을 미칩니다.
* 반발 : 전자는 음으로 하전되어 서로를 격퇴합니다. 이 반발은 전자의 공간 배열에 영향을 미쳐 특정 모양을 초래합니다.
3. 분자 형상 :
* 본딩 : 원자가 분자를 형성하기 위해 결합 할 때, 분자의 형상은 원자의 배열에 의해 결정되며, 이는 차례로 개별 원자의 형태에 의해 영향을 받는다.
* VSEPR 이론 : 원자가 쉘 전자 쌍 반발 (VSEPR) 이론은 중앙 원자 주위의 전자 쌍 (결합 및 비 결합) 사이의 반발을 고려하여 분자의 형상을 예측하는 데 도움이됩니다.
예 :
물 분자 (HATER)를 고려하십시오.
* 산소 원자 : 외부 껍질에 2 개의 고독한 쌍이 있고 수소 원자에 2 개의 결합 쌍이있는 8 개의 전자가 있습니다.
* 전자 배열 : 고독한 쌍은 서로를 격퇴하고 결합 쌍이 쌍을 이루어 구부러진 또는 V 자형 형상을 초래합니다.
* 분자 모양 : 물 분자의 전체 모양은 전자의 배열로 인해 구형이 아니라 구부러진 것입니다.
요약하면, 원자의 형상은 전자의 배열, 전자 사이의 반발 및 분자를 형성하는 결과 결합 패턴 사이의 상호 작용에 의해 결정된다. .