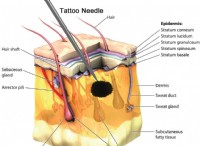
화학 이해
산성 배지에서 * so₂ : 산성 용액에서, SO태는 주로 바이 설파이트 이온 (HSOA) 및 설파이트 이온 (SOJET)과 평형에 존재한다. 평형은 바이 설파이트 이온의 형성을 선호한다.
알칼리성 매체의 * so₂ : 알칼리성 용액에서, pH는 더 높아서 황산염 이온의 형성을 촉진한다 (SOJERTER.
알칼리성 배지에서 더 강력한 감소 전력을위한 이유
열쇠는 관련 종에서 황의 산화 상태의 차이입니다.
* so₂ : 황은 산화 상태가 +4입니다.
* 황산염 이온 (so₃²⁻) : 황은 산화 상태가 +4입니다.
* 설페이트 이온 (So₄²⁻) : 황은 산화 상태가 +6입니다.
* 전력 감소 : 환원제는 전자를 기증하여 산화된다. 물질이 산화되기 쉬울수록 감소력이 강해집니다.
설명
1. 산성 조건에서 , 지배적 인 종은 HSOA이며, 황은 이미 상대적으로 높은 산화 상태 (+4)를 가지기 때문에 so₄²으로 쉽게 산화되지 않습니다.
알칼리성 조건에서 2. , 지배적 인 종은 soant²⁻입니다. 황산염 이온 (so₃²⁻)은 음전하로 인해 전자 밀도가 더 높기 때문에 설페이트 (SO₄²⁻)로 더 쉽게 산화 될 수 있습니다. 이것은 알칼리성 조건에서 더 강한 환원제가된다.
실용적인 예
일반적인 예는 물이 존재할 때 SoS와 요오드 (IA)와의 반응입니다.
* 산성 : So₂ + i 2 + 2h₂o → 2hi + h₂so₄
* 알칼리성 : so₃²₃ + i⁻ + 2oh⁻ → 2i⁻ + so₄²⁻ + h₂o
알칼리성 조건에서, 황산염 이온 (SOJET)은 요오드에 의해 황산염 (SOJET)에 쉽게 산화되어 더 강한 감소 전력을 나타냅니다.
요약 : 알칼리성 배지에서 증가 된 전자 밀도 및 더 높은 농도의 황산염 이온은 산성 대응 물에 비해 더욱 강력한 환원제를 만듭니다.