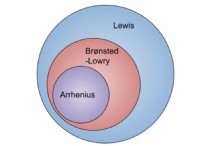
* 화학 결합 : 원자가 전자는 다른 원자와 화학적 결합을 형성하는 데 관여하는 전자입니다. 그것들은 원자를 함께 유지하는 "접착제"이며 분자와 화합물의 형성을 가능하게합니다.
* 반응성 : 원자가 전자가 적은 원자는 안정적인 전자 구성을 달성하기 위해 전자를 얻거나 잃고 싶어하기 때문에 더 반응성이 높은 경향이 있습니다. 외부 껍질이 가득 찬 원자 (고귀한 가스와 같은)는 매우 반응하지 않습니다.
* 주기적 추세 : 원자가 전자의 수는 주기율표에서 요소의 위치를 결정하고 화학적 특성에 영향을 미칩니다. 동일한 그룹 (컬럼)의 요소는 동일한 수의 원자가 전자를 가지므로 유사한 반응성을 초래합니다.
* 이온 결합 : 원자가 원자가 전자를 얻거나 잃으면 이온이되어 정전기력을 통해 서로 끌어 이온 결합을 형성합니다.
* 공유 결합 : 원자가 원자가 전자를 공유 할 때, 공유 결합을 형성하여 전자를 공유하여 안정적인 구성을 달성합니다.
이런 식으로 생각하십시오 : 원자를 사람들로 상상해보십시오. 원자가 전자는 손과 같습니다. 그것은 손을 통해 다른 사람들과 상호 작용하고, 악수 (이온 결합), 손을 잡고 (공유 결합), 심지어 싸우는 (높은 반응성)입니다.
결론적으로, 가장 바깥 에너지 수준의 원자가 전자의 위치는 원자의 화학적 거동을 결정하는 데있어 핵심 플레이어가됩니다. 그것들은 일부 요소가 반응성이고 다른 요소가 불활성 인 이유이며, 원자가 상호 작용하는 방법을 지배하여 세계에서 겪는 다양한 분자와 재료를 형성합니다.