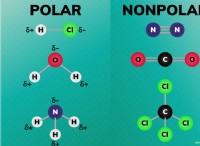
1. 중앙 원자 주위의 전자 그룹의 수를 결정하십시오.
* 전자 그룹에는 고독한 쌍 및 결합 쌍이 포함됩니다.
2. 전자 그룹의 수를 하이브리드 화와 관련시킵니다.
* 2 전자 그룹 =SP 혼성화
* 3 전자 그룹 =SP² 하이브리드 화
* 4 전자 그룹 =SP³ 혼성화
* 5 전자 그룹 =sp³d 혼성화
* 6 전자 그룹 =sp³d² 하이브리드 화
이제 각 분자를 분석 해 봅시다 :
* secl6 : 셀레늄 (SE)에는 6 개의 결합 쌍 (고독한 쌍이 없음)이 있습니다. 따라서 6 개의 전자 그룹과 SP³d² 하이브리드 화가 있습니다.
* xecl4 : 크세논 (XE)에는 4 개의 결합 쌍과 주변에 2 개의 고독한 쌍이 있습니다. 따라서 6 개의 전자 그룹과 SP³d² 하이브리드 화가 있습니다.
* if5 : 요오드 (I)는 5 개의 결합 쌍과 그 주위에 1 개의 고독한 쌍을 갖는다. 따라서 6 개의 전자 그룹과 SP³d² 하이브리드 화가 있습니다.
* ascl5 : 비소 (AS)에는 5 개의 결합 쌍이 있으며 그 주위에는 고독한 쌍이 있습니다. 따라서 5 개의 전자 그룹과 SP³D 혼성화가 있습니다.
결론 :
세 분자 중 (Secl6, Xecl4 및 If5)는 중심 원자에 sp³d² 하이브리드 화를 갖는다.