다음은 고장입니다.
1. 평형 : 순방향 및 역 반응의 속도가 동일 한 상태, 즉 반응물 및 생성물의 농도에는 순 변화가 없음을 의미합니다.
2. 제품 추가 : 이것은 제품의 농도를 증가시켜 평형에 스트레스를줍니다.
3. 왼쪽으로 이동 : 응력에 대응하기 위해 시스템은 역 반응 (생성물에서 반응물)을 선호하여 추가 된 제품 중 일부를 소비합니다. 이것은 새로운 평형이 확립 될 때까지 계속 될 것입니다.
예 :
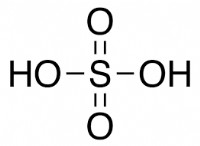
가역적 반응을 고려하십시오.
```
a + b + c + d
```
더 많은 'C'(제품)를 추가하면 시스템이 왼쪽으로 이동하여 추가 된 'C'를 소비하고 더 많은 'a'및 'b'를 형성합니다.
중요한 참고 : 이동의 정도는 농도 변화의 크기와 반응의 평형 상수 (k)에 의존한다.