원자가 쉘에 8 개의 전자가있는 원자는 마지막 궤도를 완전히 채워서 전자 구성이 가장 가까운 고귀한 가스와 유사하기 때문에 가장 안정적입니다.
많은 아시아 문화에 따르면 8 번은 운이 좋은 숫자입니다. 중국인은 발음 bā 이기 때문에 운이 좋은 수를 고려합니다. fā, 과 유사합니다 부를 의미합니다. 흥미롭게도, 베이징 하계 올림픽은 2008 년 8 월 8 일 오후 8시에 8 초, 8 분에 열렸습니다.
일본인은 일본인 8 대 스크립트가 八이기 때문에 번영에 대한 아이디어와 관련하여 운이 좋은 숫자라고 생각합니다.
화학에서 "8"의 중요성
화학에서 8은 운이 좋은 숫자가 아니라 안정성을 나타내는 숫자입니다. 8의 규칙 또는 옥셋 규칙은 원자가가 원자가 쉘에 8 개의 전자를 갖는 경향입니다.
이 최종 쉘의 8 개의 전자는 원자가 안정적이고 반응하지 않도록합니다.
예를 들어, 고귀한 가스는 자연에서 찾을 수있는 가장 비 반응성 화학 요소 중 하나입니다. 그들은주기적인 테이블의 가장 오른쪽 부분을 구성하며 자급 자족하기 때문에 고귀한 가스로 알려져 있습니다! 마지막 쉘에 2, 8, 18 또는 36 전자가 있습니다.
고귀한 가스는 주기율표의 가장 오른쪽 부분을 구성합니다 (사진 크레디트 :Julie Deshaies/Shutterstock)
원자가 껍질 (또는 가장 바깥 쪽 쉘)이 불완전 할 때 원자가 반응성이있는 경향이 있습니다. 완전한 상태 또는 닫힌 쉘을 달성하기 위해 원자는 세 가지 중 하나를 수행합니다 :전자를 다른 원자와 잃거나 얻거나 공유하십시오.
원자는 우리가 생각하는 것만 큼 간단하지는 않지만, 양성자와 전자가 몇 개있는 핵이지만, 원자의 전자 구성이라고 불리는 동심원에 배열 된 여러 껍질의 조합입니다. 원자가 쉘은 직접 뛰어 들어가는 까다로운 개념이 될 수 있으므로 기본부터 시작하겠습니다.
원자의 전자 구성은 무엇입니까?
원자의 전자 구성은 원자에서 전자의 분포입니다. 행성이 태양 주위로 회전하는 태양계를 상상해보십시오. 마찬가지로, 원자는 별개의 전자 쉘에서 중심 핵 주위에 회전하는 전자를 가지고 있습니다.
1913 년 덴마크 물리학 자 닐스 보어 (Niels Bohr)가 발견 한 보어 모델은 원자의 전자가 전자 껍질에 포함되어 있음을 시사하는 최초의 모델이었다. 이 쉘은 특정 수의 전자가 그 일부가되도록 허용합니다. 다른 과학자는이 이론을 발전시켜 강의 중 하나에서 독특한 발견을 발견했습니다.
미국의 물리 화학자이자 길버트 뉴턴 루이스 교수는 헬륨 원자와 마찬가지로 원자가 껍질에 2 개의 전자가있는 8 개의 전자가 연속적인 껍질로 배열되어 큐브의 모서리를 모방 할 수 있다고 밝혔다. 이 배열은 고귀한 가스와 유사하기 때문에 매우 안정적인 원자 상태로 이어졌습니다.
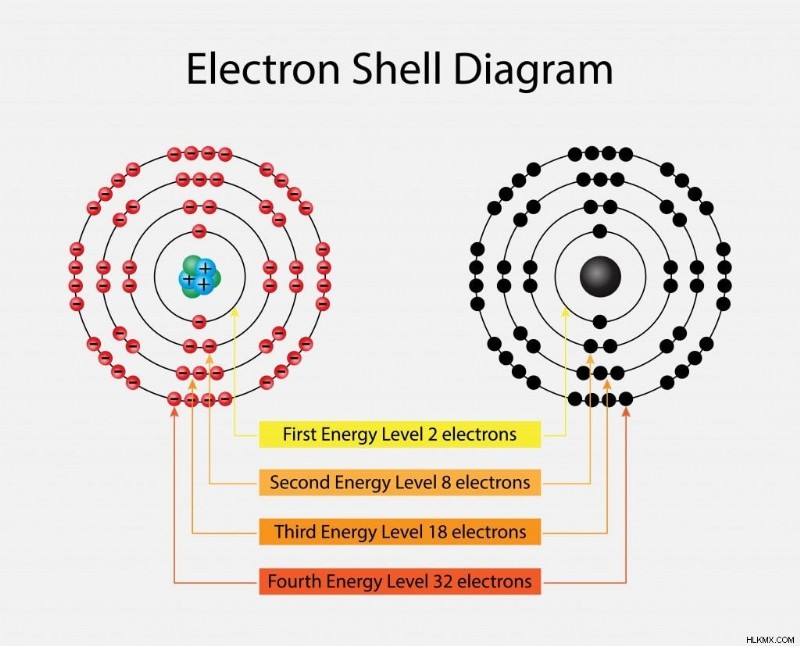
전자의 n 번째 쉘은 2N2의 전자 수를 수용 할 수 있으며, 여기서 n 주요 양자 수 또는 에너지 수준입니다. 양자 역학에는 전자의 고유 한 상태를 지정하기 위해 원자의 모든 전자에 할당 된 4 개의 양자 수가 있습니다. 전자의 이러한 양자 상태는 전자의 파도 같은 특성 또는 궤도를 보충합니다. 이것은이 기사의 범위를 벗어난 고급 화학의 일부를 형성합니다. 필요한/원하는 경우 추가 읽기가 권장됩니다.
따라서 n =1, 즉 첫 번째 쉘이면 전자 수는 해당 쉘의 경우 2가됩니다. n =2의 경우 숫자는 8, (2, 8, 18, 32…)입니다. 쉘은 K, L, M, N 등으로도 알려져 있습니다. 에너지 수준과 관련된 에너지는 우리가 핵에서 멀어지면서 증가합니다. 낮은 에너지 수준에서 전자와 핵의 반대 전하는 전자가 핵에 단단히 결합되도록합니다. 전자가 핵으로부터 더 많이있을수록 더 반응성이 높아집니다.
원자 궤도의 에너지 수준 (사진 크레디트 :nasky/ shutterstock)
이제 생각할 수도 있습니다. 왜이 모든 전자를 하나의 껍질로 조정하고 화학을 좀 더 쉽게 만들어주지 않겠습니까? ! 글쎄, 또 다른 과학자 인 볼프강 파울리 (Wolfgang Pauli)는 아마도 같은 의심을 가지고 있었기 때문에 전자 행동에 대한 흥미로운 사실을 발견하게되었습니다.
.Pauli는 1925 년에 Pauli 배제 원칙을 통해 두 개의 전자가 동일한 궤도를 차지할 수 없으며 동일한 궤도에 반대의 스핀을 가져야한다는 것을 확인했습니다. 요컨대, 쉘에는 서브 쉘이 있으며, 각 하위 쉘은 하나 이상의 원자 궤도로 구성됩니다. 각 궤도는 각각 반대 스핀으로 2 개의 전자 만 담을 수 있습니다.
하위 쉘과 궤도는 무엇입니까?
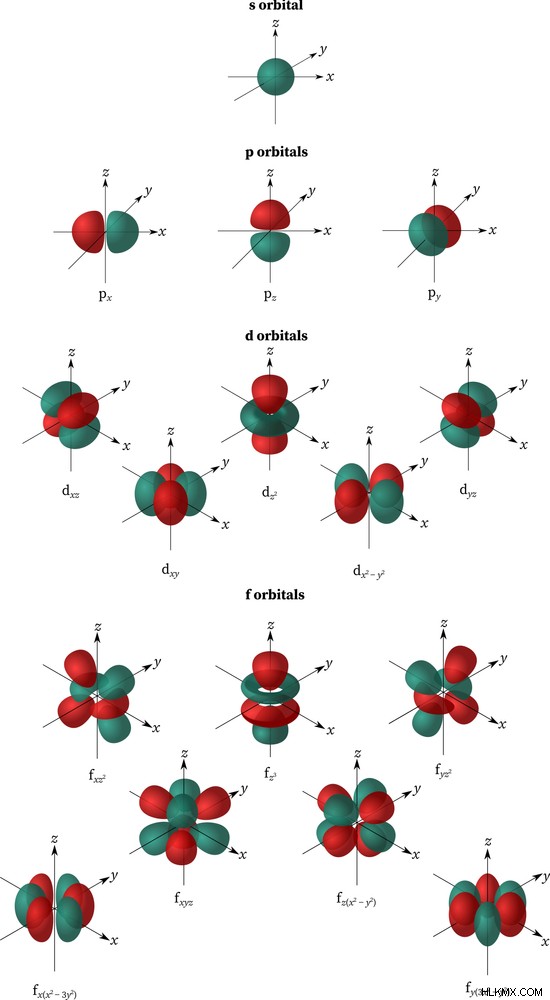
쉘은 원칙적 양자 수가 동일한 하위 쉘 모음입니다 ( n ). 서브 쉘은 동일한 주요 양자 수를 공유하는 궤도 그룹입니다 ( n ) 및 방위각 양자 수 ( ), 4 개의 양자 번호 중 두 번째. 의 값 (0,1,2,3)는 s, p, d, 에 해당합니다 및 f 전자 쉘의 라벨. 0에서 n 까지 값을 취할 수 있습니다 -1, 특정 서브 쉘의 모든 궤도에는 2 가 있습니다. + 1 변전소.
n =1 일 때, =0이며 s 에 해당합니다 변전소 1 개만있는 궤도 [2 (0) +1 =2]; =1은 p 입니다 3 개의 물체 (px, py, pz)를 갖는 궤도; =2는 d 입니다 5 개의 변전소로; 및 ℓ = 3은 f 입니다 7 개의 물체가있는 궤도. 모든 궤도마다 모양이 다릅니다. s 궤도는 구형이며 p 입니다 아령 모양, d 입니다 하나의 독특한 모양과 f 의 클로버 잎입니다 d 의 더 복잡한 버전입니다 궤도 함수. 또한 모든 궤도는 반대 방향으로 회전하는 2 개의 전자 만 담을 수 있습니다. S와 P 궤도 만 옥넷 규칙에 관여합니다.
원자 궤도 형태 (사진 크레디트 :ChemistryGod/Shutstock)
총 11 개의 전자가있는 나트륨 (11) 원자를 고려해 봅시다. 위의 정보에 따라 전자 분포를 계산하면 나트륨에 3 개의 껍질이 있음을 알 수 있습니다. 첫 번째 쉘에는 2 개의 전자가 포함되고 두 번째 쉘에는 8이 있으며 3 번째 쉘에 1 개의 고독한 전자가 남아 있습니다.
전자 구성은 2, 8, 1입니다. 첫 번째 쉘은 1 궤도 (n =1 및 l =0) 만 가지며 2 개의 전자를 수용합니다. 두 번째 쉘에는 8 개의 전자와 2 개의 궤도가 있습니다. 처음 2 개의 전자는 s 의 일부를 형성합니다. 궤도 및 p 의 다른 6 개 궤도 (n =2 및 l =1). 마지막 전자는 세 번째 쉘에 들어가서 S 궤도의 일부가 될 것입니다. 전자 구성은 다음과 같습니다.
1S2 2S2 2P6 3S1
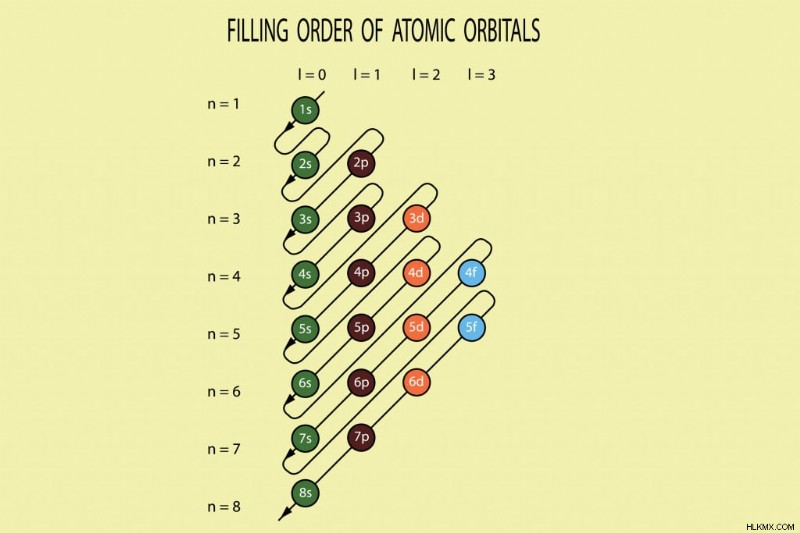
원자의 궤도에있는 전자의 충전 순서. 낮은 에너지 수준이 먼저 채워집니다. (사진 크레딧 :Amalakanti Satya Sarada/Shutterstock)
3 번째 쉘의 단일 전자는 나트륨 원자를 불안정하고 반응성으로 만드는 이유입니다. 원자가 쉘의 불완전한 수의 전자로 인해 나트륨은 개방 쉘을 갖는 것으로 알려져 있습니다. 안정성을 얻기 위해, 마지막 궤도 형태 공유 또는 이온 결합에서 전자는 다른 사람들과의 전자를 얻습니다. 이 결합은 마지막 쉘에 8 개의 전자와 더 안정적인 분자를 갖는 원자를 모두 둡니다.
나트륨은 가장 가까운 고귀한 가스와 같은 상태를 달성하려고합니다. 네온의 원자가 쉘에는 8 개의 전자가 완성되며 닫힌 쉘이 있습니다. 전자 구성은 다음과 같습니다.
네온 (10) :2,8 또는 1S22S22P6
대부분의 다른 요소는 가장 가까운 고귀한 가스와 유사한 상태에 도달하기 위해 공유 또는 이온 결합을 형성하려고합니다. 고귀한 가스의 전자 구성 중 일부는 다음과 같습니다.
아르곤 (18) :1S22S22P63S23P6
Krypton (36) :1S22S22P63S23P6 3D¹⁰ 4S² 4p⁶
캡션 :고귀한 가스의 전자 구성.
모든 껍질이 완성되고 각 궤도는 적절한 수의 전자로 채워져 있으며 결과적으로 고귀한 요소는 매우 안정적입니다. 다른 분자가 제공 할 것이 없기 때문에 그들과 상호 작용할 가능성은 없습니다. 당신이 줄타기 워커이고 균형을 잡기 위해 지팡이를 가지고 있다고 상상해보십시오. 넘어 질까 두려워 지팡이를 포기하고 싶지 않을 것입니다. 동시에, 다른 사람이 균형에 영향을 줄 수 있기 때문에 다른 사람이 당신을 도울 수 있기를 원하지 않을 것입니다. 마찬가지로, 고귀한 요소는 너무 안정적이어서 전자를 얻거나 잃어야 할 필요성이 존재하지 않습니다.
옥트 규칙에 대한 예외
길버트 루이스 (Gilbert Lewis)는 옥트 규칙이 모든 요소에 보편적으로 적용될 수 없다는 것을 알고있었습니다. 1916 년에 발견 된 분자의 수는 상당히 적었고, 결과적으로 옥트 규칙은 자연의 규칙으로 간주되었습니다. 수년에 걸쳐,이 규칙은 사람들의 마음에 너무 뿌리 내려서 규칙에 대한 예외가 실제로 포함보다 많다는 것을 받아들이 기가 어려웠습니다!

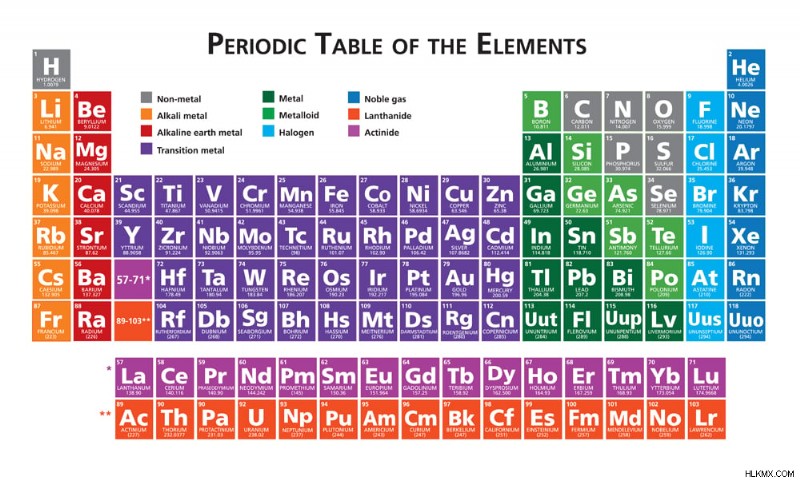
주기 테이블 (사진 크레딧 :Julie Deshaies/Shutterstock)
결과적으로,주기 테이블의 메인 그룹 (그룹 1, 2, 14-18)에 속하는 요소만이 옥트 규칙을 따르고 다른 물질의 엄청난 덩어리를 남깁니다. 일반적인 예외에는 홀수의 전자가있는 분자와 원자가 8 개 이상의 전자를 갖는 분자가 포함됩니다.
결론
옥트 규칙은 원자의 반응성 특성을 식별하는 데 중추적이다. 원자가 공유 또는 이온 결합을 형성하는지 여부는 Lewis 전자 점 구조로부터 식별 할 수있다. 원자는 지속적으로 안정성을 찾고, 따라서 고귀한 요소와 유사한 전자 구성을 갖기 위해 화학적 결합을 형성합니다. 옥트 규칙이 모든 요소에 보편적으로 적용되는 것은 아니지만 화학에 대한 우리의 이해의 기초를 형성합니다!












