1. 중앙 원자를 결정하십시오 :
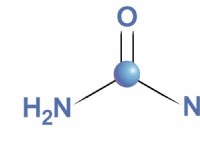
* 탄소 (C) 수소 탄산염 이온 (HCO)의 중심 원자입니다.
* 질소 (N) 암모늄 이온 (NH₄⁺)의 중심 원자입니다.
2. 총 원자가 전자를 계산하십시오 :
* 질소 (N) : 5 원자가 전자
* 수소 (H) : 1 원자가 전자 x 5 =5 원자가 전자
* 탄소 (C) : 4 원자가 전자
* 산소 (O) : 6 원자가 전자 x 3 =18 원자가 전자
* 총 : 5 + 5 + 4 + 18 =32 원자가 전자
3. 골격 구조를 그립니다 :
* 수소 탄산염 이온 (HCO₃⁻) :
* 탄소는 3 개의 산소 원자에 결합 된 중앙 원자입니다.
* 하나의 산소는 탄소로 이중 결합됩니다.
* 다른 두 산소는 탄소에 단일 결합되어 있으며 고독한 수소 원자가 부착되어 있습니다.
* 암모늄 이온 (NH₄⁺) :
* 질소는 4 개의 수소 원자에 결합 된 중앙 원자입니다.
4. 나머지 전자를 분배하십시오 :
* 외부 원자 (산소 및 수소)의 옥셋을 완성하여 시작하십시오.
* 그런 다음 중앙 원자 (탄소 및 질소)의 문어를 채 웁니다.
5. 공식 요금 :
* 탄소에 이중 결합 된 산소 원자는 공식적인 전하가 0입니다.
* 산소 원자는 탄소에 단일 결합되고 수소 원자가 부착 된 것은 -1의 공식 전하를 갖는다.
* 수소 원자가없는 탄소로 단일 결합 된 산소 원자는 공식적인 전하가 -1입니다.
* 암모늄 이온의 질소 원자는 공식적인 전하가 +1입니다.
6. 전반적인 요금을 표시하십시오 :
* 수소 탄산염 이온 (HCO)에는 -1 전하가 있습니다.
* 암모늄 이온 (NH₄⁺)은 +1 전하가 있습니다.
최종 루이스 구조 :
암모늄 수소 탄산염 (NH₄HCO₃)의 최종 루이스 구조는 이온 성적 결합에 의해 함께 고정 될 때 암모늄 이온과 탄산염 이온을 개별적으로 보여줍니다.
[nh n] ⁺ [hco₃] ⁻
수소 탄산염 이온 (HCO₃⁻) :
* 탄소 원자는 하나의 산소 원자와 2 개의 다른 산소 원자를 갖는 단일 결합과 이중 결합을 갖는다.
* 단일 결합 산소 원자 중 하나는 수소 원자가 부착되어 있습니다.
* 이중 결합이있는 산소 원자는 공식적인 전하가 0입니다.
* 다른 두 산소 원자의 공식 전하는 -1입니다.
암모늄 이온 (NH₄⁺) :
* 질소 원자는 수소 원자를 갖는 4 개의 단일 결합을 갖는다.
* 질소 원자는 공식적인 전하가 +1입니다.
키 포인트 :
* 암모늄 수소 탄산염은 이온 성 화합물입니다.
* 루이스 구조는 원자의 실제 3D 배열이 아니라 전자의 결합 및 고독한 쌍을 보여줍니다.
* 공식 전하는 분자 내 전자 분포를 이해하는 데 도움이됩니다.