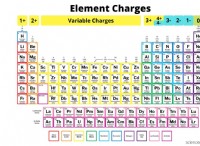
1. 알칼리 금속 (그룹 1) : 리튬 (LI), 나트륨 (NA), 칼륨 (K), 루비듐 (RB), 세슘 (CS) 및 프랑크 (FR). 이 금속에는 하나의 원자가 전자가 있는데, 이는 +1 양이온을 형성하기 위해 쉽게 잃어 버립니다. 그들은 염소와 격렬하게 반응하여 이온 성 화합물 (예 :NaCl- 테이블 소금)을 형성합니다.
2. 알칼리성 지구 금속 (그룹 2) : 베릴륨 (BE), 마그네슘 (MG), 칼슘 (CA), 스트론튬 (SR), 바륨 (BA) 및 라듐 (RA). 이 금속에는 2 개의 원자가 전자가 있으며 형태 +2 양이온이 있습니다. 또한 알칼리 금속보다 덜 폭력적이지만 염소와 반응하여 이온 성 화합물 (예 :CACL2- 염화 칼슘)을 형성합니다.
3. 전이 금속 : 많은 전이 금속은 염소와 결합하여 다양한 화합물을 형성 할 수 있습니다. 몇 가지 예는 다음과 같습니다.
* 철 (FE) :FECL2 (철 (II) 클로라이드) 및 FECL3 (철 (III) 클로라이드) 형태
* 구리 (CU) :Cucl (구리 (I) 클로라이드) 및 Cucl2 (구리 (II) 클로라이드) 형태
* 아연 (Zn) :형태 ZnCl2 (아연 염화 아연)
* 니켈 (NI) :Forms NICL2 (니켈 (II) 클로라이드)
* 코발트 (CO) :Cocl2 (코발트 (II) 클로라이드) 형태
4. 비금속 : 염소는 또한 다른 비금속과 공유 결합을 형성 할 수 있습니다. 몇 가지 예는 다음과 같습니다.
* 수소 (H) :형태 HCl (염화 수소)
* 산소 (O) :형태 Cl2O (디클로린 일산화염)
* 질소 (N) :형태 NCL3 (질소 트리클로 라이드)
* 인 (P) :형태 PCL3 (인 트리클로라이드) 및 PCL5 (인 펜타 클로라이드)
* 황 (S) :SCL2 (황화물) 및 SCL4 (황색 테트라 클로라이드) 형태
5. 메탈 로이드 : 비소 (AS) 및 안티몬 (SB)과 같은 일부 메탈 로이드는 또한 염소와 결합하여 공유 화합물을 형성 할 수 있습니다.
중요한 메모 :
* 다양한 원소와 염소의 반응성은 온도, 압력 및 다른 요소의 존재와 같은 요인에 영향을받습니다.
* 염소는 많은 원소와 쉽게 결합되지만 결과 화합물의 안정성과 특성은 크게 다를 수 있습니다. 일부 염소 화합물은 안정적이고 일반적으로 발견되는 반면, 다른 염소 화합물은 반응성이 높고 잠재적으로 위험합니다.
염소 화합물의 특정 특성과 처리하거나 사용하기 전에 잠재적 인 위험을 알고 있어야합니다.