전기 (이온) 화합물 :
* 고정 구조 : 이온 성 화합물은 양으로 하전 된 양이온 및 정전기력에 의해 함께 유지 된 음으로 하전 된 음이온으로 구성됩니다. 이온의 배열은 특정 결합 배열이 아니라 전기 중립에 필요한 전하의 비율에 의해 결정된다. 결정 격자 내에서 이온의 배열에는 유연성이 없습니다.
* 중앙 원자가 없음 : 이온 성 화합물에는 중심 원자가 없습니다. 이성질체는 대부분의 경우 중심 원자 주변의 원자의 다른 배열 가능성에 의존합니다.
* 다중 채권 없음 : 이온 결합은 공유하지 않고 전자의 전달에 의해 형성된다. 이것은 다른 공간 배열을 허용 할 수있는 이중 또는 트리플 본드가 없음을 의미합니다.
공유 화합물 :
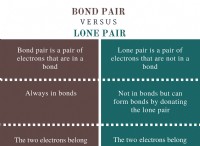
* 다중 결합 가능성 : 공유 결합은 전자의 공유를 포함하여 단일, 이중 및 삼중 결합을 형성 할 수 있습니다. 이것은 중앙 원자 주위에 원자의 다른 가능한 배열을 만듭니다.
* 중앙 원자 : 공유 화합물은 종종 다른 원자가 결합하는 중심 원자를 갖는다. 이들 주변 원자의 다른 배열은 다른 이성질체를 유발할 수있다.
* 공간 배열 : 공유 화합물에서 분자의 형상은 결합 쌍의 수와 고독한 전자 쌍과 같은 인자에 의해 영향을받습니다. 이것은 원자의 다른 공간 배열을 허용하여 이성질체를 유발합니다.
예시 예 :
* 이온 : 염화나트륨 (NaCl)은 결정 격자에서 Na+ 및 클리온의 단순하고 고정 된 배열을 갖는다. 다른 공간 배열의 가능성은 없습니다.
* 공유 : 부탄 (C4H10)은 2 개의 이성질체 :N- 부탄 (직선 체인) 및 이소 부탄 (분지 체인)으로 존재할 수있다. 이 이성질체는 다른 분자 구조로 인해 다른 특성을 갖는다.
요약하면, 전기성 화합물은 원자의 상이한 배열을 형성 할 수있는 구조적 유연성 및 결합 특성이 없으며, 이는 이성질체의 기초이다. .