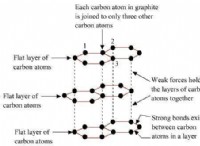
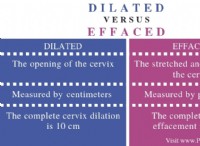
1. 산화 환원 반응 균형 :
* 산성 솔루션 : 산성 솔루션에서는 반 반응의 균형을 맞추기 위해 HATION과 HALO를 사용합니다.
* 산소 원자의 균형을 맞추기 위해 더 많은 산소가 필요한 측면에 h₂o를 첨가합니다.
* 수소 원자의 균형을 맞추기 위해 더 많은 수소가 필요한 측면에 h⁺를 첨가합니다.
* 기본 솔루션 : 기본 솔루션에서는 반 반응의 균형을 맞추기 위해 OH 이온과 HATOO를 사용합니다.
* 산소 원자의 균형을 맞추기 위해 더 많은 산소가 필요한 측면에 h₂o를 첨가합니다.
* 수소 원자의 균형을 맞추기 위해 더 많은 수소가 필요한 측면에 h₂O를 추가 한 다음 산소의 균형을 맞추기 위해 반대쪽에 OH를 추가합니다.
2. 반응 메커니즘 :
* 산성 솔루션 : 산성 용액에서, 반응 메커니즘은 종종 반응물 또는 중간체의 양성자 화를 포함하여 전자 전달을 촉진 할 수있다.
* 기본 솔루션 : 기본 용액에서, 반응 메커니즘은 종종 반응물 또는 중간체의 탈 양성자 화를 포함하여 전자 전달에도 영향을 줄 수있다.
예 :
칼륨 과망간산 칼륨 (kmno₄)과 철 (II) 이온 (Fe²⁺) 사이의 산화 환원 반응을 고려하십시오.
산성 용액에서 :
```
mno₄⁻ + 8h₄⁻ + 5e⁻ → mn²⁺ + 4h₂o (감소 반 반응)
Fe²⁺ → Fe³⁺ + E⁻ (산화 반 반응)
```
기본 솔루션에서 :
```
mno₄⁻ + 2h₄⁻o + 3e⁻ → mno₂ + 4oh⁻ (감소 반 반응)
Fe²⁻ + 2oh⁺ → Fe (OH) ₂ + 2e⁻ (산화 반 반응)
```
보시다시피, 밸런싱 공정과 전체 반응 생성물은 산성 및 기본 솔루션에서 다릅니다.
요약 :
* 밸런싱 : 산성 솔루션은 H use 및 HALO를 사용하는 반면 기본 솔루션은 OHA 및 HATO를 사용합니다.
* 메커니즘 : 산성 용액은 종종 양성자 화를 포함하는 반면, 기본 용액에는 종종 탈 수성이 포함됩니다.
* 제품 : 반응 생성물은 용액의 pH에 따라 달라질 수 있습니다.
솔루션의 산도 또는 염기성은 밸런싱과 관련된 특정 단계 및 전체 반응 메커니즘에 영향을 미치며 궁극적으로 형성된 생성물에 영향을 미칩니다.