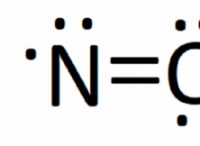이온 결합
* 강도 : 일반적으로 강하지만 변수 .
* 강도에 영향을 미치는 요인 :
* 충전 : 이온의 높은 전하는 더 강한 인력을 초래합니다 (예 :MGO는 NACL보다 강합니다).
* 크기 : 전하 밀도가 더 큰 작은 이온은 더 강한 결합을 초래합니다 (예 :LIF는 CSI보다 강합니다).
* 격자 에너지 : 이온이 결정 격자를 형성 할 때 방출 된 에너지; 더 높은 격자 에너지는 더 강한 결합을 나타냅니다.
* 기타 특성 :
* 높은 용융 및 끓는점 강한 정전기력으로 인해.
* 용융 또는 용해시 좋은 전기 도체 이온은 자유롭게 움직일 수 있기 때문입니다.
* 부서지기 강성 격자 구조는 이온을 이동시킴으로써 쉽게 파괴 될 수 있기 때문이다.
공유 결합
* 강도 : 매우 강하고 종종 이온 결합보다 강한 .
* 강도에 영향을 미치는 요인 :
* 공유 전자 수 : 더 많은 공유 전자 (다중 결합)는 더 강한 결합을 초래합니다 (예 :C =C는 C-C보다 강합니다).
* 결합 길이 : 짧은 결합이 더 강합니다 (예 :C-H는 C-Cl보다 강하다).
* 전기 음성 차이 : 큰 전기 음성 차이는 공유 결합을 분극하여 파괴에 더 취약하게 할 수 있습니다.
* 기타 특성 :
* 높은 용융 및 끓는점 강한 결합 (예 :다이아몬드)을 갖는 비극성 분자의 경우.
* 가난한 전기 도체 전자가 분자 내에 국한되기 때문에 고체 또는 액체 상태에서.
* 유연성 (경우에 따라) 채권이 회전 할 수 있기 때문입니다.
요약
이온 결합은 일반적으로 강한 것으로 생각되지만 공유 결합은 종종 더욱 강할 수 있습니다. 두 유형의 채권의 강점은 여러 요인에 따라 달라 지므로 간단한 일반화를 만드는 데 어려움이 있습니다.