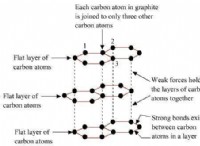
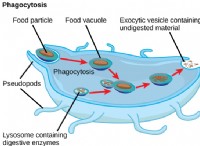
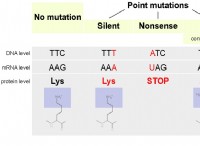
* 수산화 마그네슘은베이스입니다 : 산과 반응하여 염과 물을 형성합니다.
* 산성 솔루션에는 H+ 이온이 포함되어 있습니다. 이들 이온은 수산화 마그네슘으로부터 수산화물 이온 (OH-)과 반응하여 물을 형성한다.
* le chatelier의 원리 : 용액으로부터 수산화 이온의 제거는 평형을 수산화 마그네슘을 용해시켜 손실 된 이온을 보충하는 것으로 이동시킨다.
간단한 용어로 : 산성 환경은 수산화물 이온을 중화시켜 수산화 마그네슘이 용해되도록합니다.
이것을 순수한 물과 대조하십시오 : 순수한 물에서, 수산화 마그네슘의 용해도는 낮은 용해도 생성물 상수 (KSP)에 의해 제한된다. 이 고유 한 수준을 넘어서 용해시킬 수있는 원동력은 없습니다.