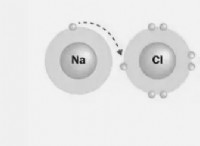
* 분자 화합물은 일반적으로 비 전해질이다 : 그들은 물에 용해 될 때 이온으로 분리되지 않습니다. 이것은 그들이 용액의 전도성에 기여하지 않음을 의미합니다.
* 탈 이온수는 완벽하게 순수하지 않습니다 : 고품질의 탈 이온수조차도 작지만 측정 가능한 전도성에 기여하는 흔적 불순물을 갖습니다.
* 전도도는 전기를 전도하는 솔루션의 능력을 측정 한 것입니다. 이것은 이온의 존재 및 움직임과 직접 관련이 있습니다. 분자 화합물은 이온을 형성하지 않기 때문에, 그들의 용액은 전도도가 낮으며, 탈 이온수의 작은 전도도를 빼면 결과가 크게 변화되지 않습니다.
뺄셈이 고려 될 수있는 경우 :
* 매우 희석 된 솔루션 : 강한 전해질의 매우 희석 된 용액에서, 탈 이온수의 전도도는 전체 전도도의 더 큰 비율이 될 수있다. 이러한 경우, 탈 이온수 전도도를 빼는 것은 전해질의 기여를보다 정확하게 측정하는 것으로 간주 될 수있다.
* 반응의 전도도 변화 측정 : 분자 화합물과 관련된 화학 반응 동안 전도도의 변화를 구체적으로 측정하는 경우, 탈 이온수의 초기 전도도를 빼면 반응으로 인한 변화를 분리하는 데 중요합니다.
일반적으로 :
측정의 맥락과 솔루션의 속성을 이해하는 것이 중요합니다. 분자 화합물을 다루는 경우, 탈 이온수의 전도도를 빼면 일반적으로 불필요하며 오도 할 수도 있습니다. 솔루션 자체의 전기 능력에 대한 가장 정확한 정보를 제공하므로 용액 자체의 전도도 측정에 중점을 둡니다.