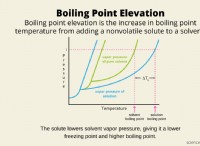
동결 지점 우울증
* 공동 속성 : 동결 지점 우울증은 공동 특성이며, 이는 특정 동일성이 아니라 용매에 용해 된 용질 입자의 * 수 *에만 의존한다는 것을 의미합니다.
* van't Hoff accasion (i) : 이 요인은 용해시 용질이 분해되는 입자의 수를 나타냅니다.
* NaCl (Ionic)은 Na+ 및 클리온으로 분리되므로 i =2.
* 테이블 설탕 (공유)은 해리되지 않으므로 i =1.
동결 지점 우울증 계산
동결 지점 우울증에 대한 공식은 다음과 같습니다.
Δt
어디:
* Δt f =동결 지점의 변화 (° C)
* i =Van't Hoff 요인
* k f =용매의 냉동 상수 (물의 경우, k f =1.86 ° C/molal)
* M =용액의 몰 (용매 kg 당 용질의 몰)
문제 해결
1. NaCl의 동결 지점 우울증 :
* Δt f =-5.9 ° C (주어짐)
* i =2 (NaCl은 2 이온으로 분리됩니다)
* 우리는 'm'(molality)을 찾아야합니다.
2. NaCl의 몰이 찾기 :
* 공식을 재 배열하십시오 :M =ΔT <서브> f / (i * k f ))
* M =-5.9 ° C / (2 * 1.86 ° C / Molal) =-1.58 Molal
3. 필요한 설탕의 질량 찾기 :
* 설탕에 대해 동일한 동결 지점 우울증 (-5.9 ° C)을 원합니다.
* i =1 (설탕은 분리되지 않습니다)
* M =-1.58 Molal (NACL과 동일)
* 설탕의 질량을 찾으려면 공식을 다시 사용하십시오.
* M =설탕 / kg의 물
* -1.58 molal =설탕의 두더지 / 0.1 kg (100 g =0.1 kg)
* 설탕 몰 =-0.158 몰
* 설탕의 어금니 질량 (342.3 g/mol)을 사용하여 두더지를 그램으로 변환합니다.
* 설탕 그램 =0.158 mol * 342.3 g/mol =54.1 그램
따라서 10 그램의 염화 나트륨과 동일한 동결 지점 우울증을 달성하기 위해 약 54.1 그램의 테이블 설탕이 필요합니다. .
중요한 메모 :
* 이것은 용질의 이상적인 거동을 가정합니다 (용질 입자 사이의 유의 한 상호 작용은 없음).
* 실제로, 실제 동결 지점 우울증은 비 이상적인 행동으로 인해 약간 달라질 수 있습니다.