1. 전자 전송 :
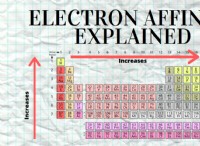
* 나트륨 (NA) 가장 바깥 쪽 쉘에 하나의 원자가 전자가 있습니다. 고귀한 가스 네온 (NE)과 같은 안정적인 전자 구성을 달성하기 위해이 전자를 쉽게 잃게됩니다.
* 불소 (f) 7 개의 원자가 전자가 있습니다. 고귀한 가스 네온 (NE)과 같은 안정적인 전자 구성을 달성하기 위해 전자가 하나 더 필요합니다.
* 나트륨과 불소가 상호 작용할 때, 나트륨 원자는 단일 원자가 전자를 불소 원자로 전달합니다.
2. 이온의 형성 :
* 나트륨 (NA) 전자를 잃고 양이온으로 알려진 양으로 하전 된 이온 (Na+)이됩니다. .
* 불소 (f) 전자를 얻고 음이온 로 알려진 음으로 하전 된 이온 (F-)이됩니다. .
3. 이온 결합 :
* 반대로 하전 된 이온 (Na+ 및 F-)은 정전기력으로 인해 서로 끌어 당깁니다. 이 매력적인 힘을 이온 결합 라고합니다 .
* 양으로 하전 된 나트륨 이온과 음으로 하전 된 불소 이온 사이의 강한 정전기 인력은 화합물을 함께 유지한다.
4. 결정 격자 형성 :
불화 나트륨은 각각의 나트륨 이온이 6 개의 불소 이온으로 둘러싸인 결정 격자 구조를 형성하고, 각 불소 이온은 6 개의 나트륨 이온으로 둘러싸여있다. 이 배열은 이온들 사이의 정전기 반발을 최소화하고 매력을 최대화시킨다.
전반적인 반응 :
반응은 다음과 같이 표현 될 수 있습니다.
```
NA + F → NA + + F- → NAF
```
불소 나트륨의 특성 (NAF) :
* 실온에서 고체
* 백색 결정질 고체
* 수용성
* 치약, 식수 불소화 및 기타 산업 응용 분야에 사용