루이스 산의 몇 가지 주요 특성은 다음과 같습니다.
* 전자 결핍 : 루이스 산은 일반적으로 빈 궤도 또는 양전하를 가지므로 전자 쌍을 수용 할 수 있습니다.
* elecropholic : 그들은 전자가 풍부한 종 (뉴 클레오 포블)에 끌리며 전자를 수용함으로써 결합을 형성 할 수 있습니다.
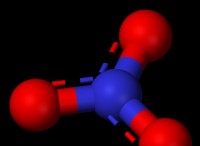
* 은 중립적이거나 긍정적으로 하전 될 수 있습니다. 예는 금속 이온, 붕소 트리 플루오 라이드 (BF3) 및 염화 알루미늄 (ALCL3)을 포함한다.
루이스 산의 예 :
* 금속 이온 : Fe3+, Cu2+, Zn2+
* 붕소 트리 플루오 라이드 (BF3) : 붕소에 빈 p- 궤도가있어 전자 쌍을 수용 할 수 있습니다.
* 클로라이드 알루미늄 (Alcl3) : BF3과 유사하게 알루미늄에 빈 P- 궤도가 있습니다.
* 카르 보닐 화합물 : 카르 보닐기 (C =O)의 탄소 원자는 전자 결핍이며 루이스 산 역할을 할 수 있습니다.
루이스 산과 달리 루이스베이스는 전자 쌍 기증자입니다. 예는 암모니아 (NH3), 물 (H2O) 및 수산화 이온 (OH-)을 포함한다.
루이스 산을 이해하는 것은 특히 유기 화학 및 무기 화학에서 많은 화학 반응을 이해하는 데 중요합니다.