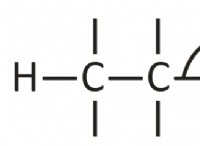이유는 다음과 같습니다.
* 공유 결합 원자 사이에 전자 공유를 포함합니다. 이것은 일반적으로 비금속 사이에서 보입니다.
* 이온 결합 한 원자에서 다른 원자로 전자를 전달하여 이온을 생성합니다 (양수 또는 음전하가있는 원자). 이것은 일반적으로 금속과 비금속 사이에서 발생합니다.
공유 결합이없는 화합물의 예 :
* NaCl (염화나트륨) :나트륨 (금속)은 전자를 염소 (비금속)로 잃어 정전기 인력에 의해 함께 유지되는 Na+ 및 클리온을 형성합니다.
* KBR (칼륨 브로마이드) :칼륨 (금속)은 전자를 브롬 (비 금속)으로 잃어 경향이있는 인력에 의해 함께 고정 된 K+ 및 브리온을 형성합니다.
* MGO (산화 마그네슘) :마그네슘 (금속)은 2 개의 전자를 산소 (비금속)로 잃고, 정전기 인력에 의해 함께 유지되는 Mg2+ 및 O2- 이온을 형성합니다.
요약 :
화합물이 금속과 비금속 사이에 형성되는 경우, 이온 성 화합물 일 수 있으며 공유 결합을 함유하지 않을 수 있습니다.