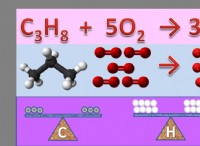
so g (g) + no₂ (g) ⇌ so₃ (g) + no (g)
이 반응은 이산화황 (SO₂) 및 이산화 질소 (NO₂) 로부터 트라이 산화 황 (SO₃) 및 질소 일산화 질소 (NO)의 형성이다. .
불행히도, 나는이 반응에 대한 평형 상수 (k)에 대한 특정 수치 값을 제공 할 수 없습니다. 이유는 다음과 같습니다.
* 평형 상수는 온도 의존적입니다. k의 값은 온도에 따라 변합니다. 평형 상수를 알고 싶은 온도를 지정해야합니다.
* 평형 상수는 실험적으로 계산되거나 측정 될 수 있습니다. 실험 데이터에 액세스 할 수 없거나 K를 결정하기 위해 복잡한 계산을 수행하는 능력이 없습니다.
평형 상수를 찾는 방법 :
1. 참조 출처에서 찾아보십시오 : 화학 교과서, 핸드북 또는 온라인 데이터베이스에서 많은 반응에 대한 평형 상수를 찾을 수 있습니다.
2. 표준 자유 에너지 변화 (ΔG °) :에서 계산하십시오 반응의 표준 자유 에너지 변화를 알고 있다면 다음 방정식을 사용할 수 있습니다.
k =exp (-Δg °/rt)
어디:
* K는 평형 상수입니다
* ΔG °는 표준 자유 에너지 변화입니다
* R은 이상적인 가스 상수입니다 (8.314 J/mol · K)
* t는 켈빈의 온도입니다
이 반응에 대한 온도 또는 표준 자유 에너지 변화가 있는지 알려 주시고 평형 상수를 계산하는 데 도움을 줄 수 있습니다. .