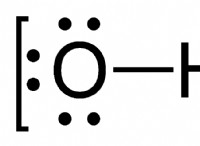1. 탄산염의 공식을 결정하십시오
당신은 당신이 다루는 카보네이트를 지정하지 않았습니다. 공식 (nh₄) ₂co₃가있는 탄산 암모늄에 대해 묻는다고 가정 해 봅시다.
2. 탄산 암모늄의 몰 질량을 계산하십시오
* (NH₄)의 어금니 질량 (NH₄) ₂co₃ =(2 * 14.01 g/mol (n)) + (8 * 1.01 g/mol (H)) + (12.01 g/mol (c)) + (3 * 16.00 g/mol (O)) =96.09 g/mol
3. 카보네이트 그램을 두더지로 변환하십시오
* (NH of) ₂co₃ =(8.903 g) / (96.09 g / mol) =0.0927 mol의 두더지
4. 암모늄 이온의 두더지를 계산하십시오
* 공식 (NH₄) ₂co₃에서, 우리는 1 몰의 탄산 암모늄마다 2 몰의 암모늄 이온 (NH₄⁺)이 있음을 알 수 있습니다.
* NH n의 두더지 =(0.0927 mol (nh₄) ₂co₃) * (2 mol nh₄⁺ / 1 mol (nh₄) ₂co₃) =0.1854 mol nh₄⁺
따라서 8.903 그램의 탄산 암모늄에 약 0.1854 몰의 암모늄 이온이 있습니다.