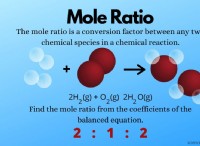
다음은 고장입니다.
* 베이스 : 베이스는 양성자 (H+ 이온)를 수용 할 수있는 물질입니다. 일반적인 예로는 수산화 나트륨 (NaOH), 수산화 칼륨 (KOH) 및 수산화 칼슘 (CA (OH) 2)가 포함됩니다.
* 비금속 산화물 : 이들은 비 금속 요소와 산소의 반응에 의해 형성된 산화물이다. 예는 이산화탄소 (CO2), 이산화황 (SO2) 및 이산화 질소 (NO2)를 포함한다.
반응 :
염기와 비 금속 산화물 사이의 반응은 염-금속 산화물과 반응하여 염과 물을 형성하는 것을 포함한다.
일반 방정식 :
```
염기 + 비금속 산화물 → 소금 + 물
```
특정 예 :
1. 이산화탄소 (CO2)와 반응하는 수산화 나트륨 (NaOH) :
```
2NAOH + CO2 → NA2CO3 + H2O
```
이 반응에서, 수산화 나트륨은 이산화탄소와 반응하여 탄산나트륨 (염) 및 물을 형성한다.
2. 수산화칼슘 (Ca (OH) 2) 이산화황 (SO2)과 반응 :
```
Ca (OH) 2 + SO2 → CASO3 + H2O
```
여기서, 수산화칼슘은 이산화황과 반응하여 황산 칼슘 (염) 및 물을 형성한다.
키 포인트 :
* 반응은 일반적으로 발열이므로 열이 방출됩니다.
* 형성된 소금은 일반적으로 물에 용해됩니다.
* 반응은 염기의 중화 및 산화 산화물을 보여줍니다.
응용 프로그램 :
이 반응에는 몇 가지 실제 적용이 있습니다.
* 산성 가스 제거 : 비 금속 산화물은 종종 산성 가스입니다. 기지는 이러한 가스를 흡수하여 대기 오염을 줄일 수 있습니다.
* 소금 생산 : 이 반응은 다양한 염의 산업 생산에 사용됩니다.
* 화학 분석 : 반응은 산성 산화물의 존재를 확인하는 데 사용될 수있다.
염기와 비금속 산화물 사이의 반응을 이해함으로써, 우리는 이러한 중요한 과정의 화학을 더 잘 파악할 수 있습니다.