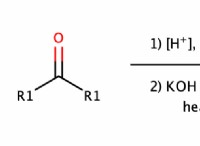
다음은 핵심 사항의 고장입니다.
* 확률 : 궤도는 전자의 고정 경로를 정의하지 않습니다. 대신, 이들은 확률 분포를 나타냅니다. 즉, 전자가 궤도 내의 특정 영역에서 발견 될 가능성이 높습니다.
* 모양 : 원자 궤도는 구 (s orbitals), 아령 (p 궤도) 및 더 복잡한 형태 (d 및 f 궤도)와 같은 특정 모양을 갖습니다. 이 모양은 전자의 에너지 수준과 각도 운동량에 의해 결정됩니다.
* 에너지 수준 : 전자는 원자 내에서 다른 에너지 수준을 차지합니다. 각 에너지 수준은 비슷한 에너지를 가진 궤도 세트에 해당합니다.
* 양자 수 : 궤도의 특성은 4 개의 양자 수 (원칙, 각 운동량, 자기 및 스핀) 세트로 설명됩니다. 이 숫자는 전자의 크기, 모양, 방향 및 스핀을 결정합니다.
본질적으로, 원자 궤도는 물리적, 콘크리트 대상이 아니라 오히려 원자에서 전자의 행동을 이해하는 데 도움이되는 수학적 모델입니다.