1. 화합물의 유형 :
* 이온 성 화합물 : 이들은 금속과 비금속 사이에 형성됩니다.
* 금속은 양이온 (양의 이온)을 형성하고 비 금속은 음이온 (음성 이온)을 형성합니다.
* 충전의 균형을 결정하려면 이온의 전하를 알아야합니다.
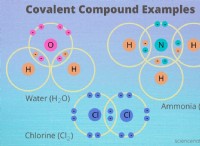
* 공유 화합물 : 이들은 두 비금속 사이에 형성됩니다.
* 각 원자가가 얼마나 많은 결합을 형성 할 것인지 결정 해야하는 원자가 전자의 수를 알아야합니다.
* 접두사는 분자에서 각 원소의 원자 수를 나타내는 데 사용됩니다 (예 :모노, 디, 트라이 등).
2. 이온의 전하 :
* 이온 화합물의 전하의 균형을 결정하는 데 필요한 비율을 결정하려면 이온 전하를 알아야합니다.
* 이것은 주기율표의 요소 그룹 번호에 의해 결정될 수 있습니다 (예 :그룹 1 금속 형태 +1 이온, 그룹 2 금속은 +2 이온, 그룹 17 비금속 형태 -1 이온)에 의해 결정될 수 있습니다.
* 전이 금속 또는 다 원자 이온의 전하를 결정하기 위해 공통 이온 표를 사용해야 할 수도 있습니다.
3. 원자가 전자 :
* 공유 화합물의 경우 각 원자가 가지고있는 원자가 전자의 수를 알아야합니다.
* 이것은 원자가 형성 될 수있는 결합 수를 알려줍니다.
예를 들어, 탄소에는 4 개의 원자가 전자가 있으며 4 개의 결합을 형성 할 수 있습니다.
4. 공유 화합물에 대한 접두사 :
* 공유 화합물의 경우, 접두사를 사용하여 분자에서 각 요소의 원자 수를 나타냅니다.
* 여기에 몇 가지 일반적인 접두사가 있습니다.
* 모노 =1
* di =2
* tri =3
* tetra =4
* 펜타 =5
* hexa =6
* hepta =7
* 옥타 =8
* nona =9
* DECA =10
5. 특별한 경우 :
* 다 원자 이온 : 이들은 둘 이상의 원자로 구성된 이온이다.
* 화합물의 다른 이온과 균형을 맞추려면 다 원자 이온의 전하를 알아야합니다.
* 수화 : 이들은 결정 구조 내에 물 분자를 함유하는 이온 성 화합물이다.
* 물 분자의 수는 도트와 수치 접두사로 표시됩니다.
예 :
* NaCl (염화나트륨) : 나트륨 (Na+)과 염소 (Cl-) 사이에 형성된 이온 성 화합물. 요금은 1 :1 비율로 균형을 이룹니다.
* CO2 (이산화탄소) : 탄소와 산소 사이에 형성된 공유 화합물. 접두사 "di"는 두 개의 산소 원자가 있음을 나타냅니다.
* fecl3 (철 (III) 염화물) : 철 (Fe3+)과 염소 (Cl-) 사이에 형성된 이온 성 화합물. 요금은 1 :3 비율로 균형을 이룹니다.
* Cuso4 · 5H2O (구리 (II) 설페이트 펜타 이드 레이트) : 물 분자가 포함 된 이온 성 화합물. "펜타"는 단위당 5 개의 물 분자가 있음을 나타냅니다.
기억하십시오 : 항상 공식이 가장 간단한 전체 수비율로 기록되어 있는지 확인하십시오.