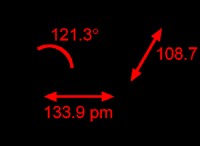
1. HCl의 두더지를 계산하십시오 :
* HCl의 몰 질량 : 1.01 g/mol (H) + 35.45 g/mol (CL) =36.46 g/mol
* HCl의 두더지 : (0.1 g HCl) / (36.46 g / mol) =0.00274 mol Hcl
2. HCl의 몰토리성을 계산하십시오 :
* Molarity (m) : (용질의 몰) / (리터의 용액의 부피)
* HCl의 몰토리성 : (0.00274 mol) / (2.5 L) =0.001096 m
3. H+ 농도 결정 :
* HCl은 강한 산으로 용액에 완전히 분리됩니다 :HCl → H + + Cl-
* 따라서, H+ 이온의 농도는 HCl의 농도와 동일하다 :[H+] =0.001096 m
4. 물의 이온 생성물 (KW)을 사용하여 OH- 농도를 계산하십시오.
* kw =[H+] [OH-] =1.0 x 10^-14에서 25 ° C
* [oh-] =kw / [h+]
* [OH-] =(1.0 x 10^-14) / (0.001096) =9.12 x 10^-12 m
따라서 :
* [h+] =0.001096 m
* [OH-] =9.12 x 10^-12 m