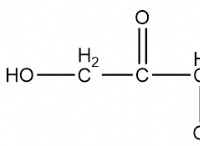
1. 황산 구리의 몰 질량을 계산하십시오
* 구리 (CU) :63.55 g/mol
* 황 (S) :32.07 g/mol
* 산소 (O) :16.00 g/mol (4 개의 산소 원자가 있습니다)
CUSO4의 어금니 질량 =63.55 + 32.07 + (16.00 x 4) =159.62 g/mol
2. Avogadro의 번호를 사용하십시오
* Avogadro의 숫자에 따르면 한 두더지의 물질에는 6.022 x 10^23 분자가 있다고합니다.
3. 비율을 설정하십시오
우리는 알고 있습니다 :
* 1 몰 CUSO4 =159.62 g
* 1 몰 CUSO4 =6.022 x 10^23 분자
우리는 3.36 x 10^23 분자의 질량 (그램)을 찾고 싶습니다. 'X'가 알려지지 않은 질량을 나타냅니다.
(159.62 g) / (6.022 x 10^23 분자) =x / (3.36 x 10^23 분자)
4. X 에 대한 해결
* 크로스-다중 :159.62 g * (3.36 x 10^23 분자) =(6.022 x 10^23 분자) * x
* 단순화 :5.36 x 10^25 =(6.022 x 10^23) * x
* 분리 x :x =(5.36 x 10^25) / (6.022 x 10^23)
* 계산 :x ≈ 88.99 g
따라서, 3.36 x 10^23 구리 황산염 분자 무게는 약 88.99 그램입니다.