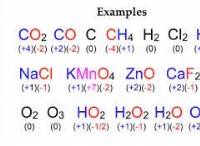
1. 금속 + 산 → 염 + 수소 가스
* 작동 방식 : 금속은 산으로부터 수소 이온 (H+)을 변위하여 염을 형성하고 수소 가스를 방출함으로써 산과 반응한다.
* 예 : 아연은 염산 아연 및 수소 가스를 형성하기 위해 염산과 반응합니다.
Zn (S) + 2HCL (AQ) → ZnCl₂ (AQ) + H₂ (G)
2. 베이스 + 산 → 소금 + 물
* 작동 방식 : 염기는 산으로부터의 수소 이온이 염기로부터 수산화물 이온 (OH-)과 반응하여 물을 형성하는 중화 반응에서 산과 반응한다. 나머지 이온은 소금을 형성합니다.
* 예 : 수산화 나트륨은 염산 나트륨 및 물을 형성하기 위해 염산과 반응합니다.
NAOH (AQ) + HCL (AQ) → NACL (AQ) + HATER (L)
3. 탄산염/중탄산염 + 산 → 염 + 물 + 이산화탄소
* 작동 방식 : 탄산염 (Co⁻²₃) 및 중탄산염 (HCO)은 산과 반응하여 이산화탄소 가스, 물 및 염을 방출합니다.
* 예 : 탄산 칼슘은 염산 칼슘, 물 및 이산화탄소를 형성하기 위해 염산과 반응합니다.
caco₃ (s) + 2hcl (aq) → caCl₂ (aq) + h₂o (l) + Co₂ (g)
4. 산화물 + 산 → 소금 + 물
* 작동 방식 : 금속 산화물은 산과 반응하여 염과 물을 형성합니다.
* 예 : 구리 산화 구리는 황산과 반응하여 황산 구리 및 물을 형성합니다.
cuo (s) + h₂so₄ (aq) → cuso₄ (aq) + h₂o (l)
5. 분해 반응
* 작동 방식 : 일부 물질은 산에 노출 될 때 분해되어 더 간단한 화합물로 분해됩니다.
* 예 : 자당 (테이블 설탕)은 농축 황산의 존재하에 분해되어 탄소, 물 및 이산화황을 생성합니다.
c ₁₂h₁₂o₁₁ (s) + h₂so₄ (conc.) → 12c (s) + 11h₂o (l) + so₂ (g)
중요한 메모 :
* 산 강도 : 산의 강도는 반응 속도와 생성물에 영향을 미칩니다. 강산은 더욱 격렬하게 반응하여 약산과 다른 제품으로 이어질 수 있습니다.
* 산 농도 : 산의 농도는 반응 속도에 영향을 미칩니다. 더 높은 농도는 일반적으로 더 빠른 반응으로 이어집니다.
* 물질의 특성 : 산과 반응하는 물질의 화학적 특성은 반응의 유형 및 형성된 생성물을 결정한다.
이것들은 몇 가지 예일 뿐이며, 특정 반응은 관련된 특정 산 및 물질에 따라 달라질 수 있습니다.