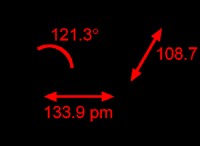
* 약한 분자간 힘 : cl 2 내의 결합이 있습니다 분자는 강하고, cl 2 사이의 힘은 강하다 분자는 약합니다. van der Waals의 힘으로 알려진이 힘은 염소가 비극성 분자이기 때문에 런던 분산 힘이 비교적 약합니다.
* 저 분자 질량 : 염소는 상대적으로 낮은 분자 질량 (70.9 g/mol)을 갖는다. 이것은 분자의 동역학 에너지가 실온에서 상대적으로 높아서 약한 분자간 힘을 극복하고 기체 상태에 더 쉽게 존재한다는 것을 의미합니다.
* 큰 원자 크기 : 염소 원자는 비교적 크기 때문에 전자 구름이 편광되기 쉽고 런던 분산 힘이 발생할 수 있습니다. 그러나, 더 큰 크기의 효과는 약한 분자간 힘에 의해 어두워진다.
요약 : 비록 cl 2 내의 공유 결합이지만 분자는 강하고, 약한 분자간 힘과 상대적으로 낮은 분자 질량은 실온 및 압력에서 염소가 가스가됩니다.