이유는 다음과 같습니다.
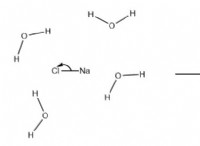
* 수소 결합 : 물 분자는 극성이 높고 서로 강한 수소 결합을 형성합니다. 이 채권은 물의 높은 비등점과 표면 장력을 담당합니다. 그러나, 고체 상태 (ICE)에서, 이들 수소 결합은 물 분자를 매우 개방적인 결정 격자 구조로 배열한다. 이 구조는 실제로 전체 분자간 힘을 약화시켜 얼음을 덜 안정적으로 만들고 에너지가 녹기 위해 적은 에너지가 필요합니다.
* 다른 고체 : 다른 많은 고체는 원자를 함께 잡고있는 이온 결합 또는 금속 결합과 같은 더 강한 분자간 힘을 가지고 있습니다. 이 힘은 파손되기 위해 훨씬 더 많은 에너지를 필요로하므로 녹는 점이 높아집니다.
예 :
* 소금 (NaCl) : 강한 이온 결합으로 인해 융점이 801 ° C입니다.
* 철 (fe) : 강한 금속 결합으로 인해 1538 ° C의 용융점이 있습니다.
요약 : 물의 수소 결합은 강하지 만 얼음에 대한 그들의 배열은 다른 많은 고체에 비해 융점이 낮은 덜 안정적인 구조를 만듭니다.