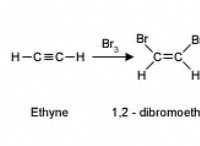
1. 화학식 :
* 금속 양이온 및 비금속 음이온의 존재 : 염은 금속 양이온 및 비금속 음이온의 이온 결합에 의해 형성된다. 예를 들어, NaCl (염화나트륨)은 Na+ (나트륨 양이온) 및 Cl- (클로라이드 음이온)의 결합에 의해 형성된다.
* 예외 : 일부 염은 또한 염화 암모늄 (NH4CL) 또는 질산 암모늄 (NH4NO3)과 같은 2 개의 비 금속 이온의 조합에 의해 형성 될 수있다.
2. 물리적 특성 :
* 외관 : 염은 종종 결정 구조를 가지며 존재하는 이온에 따라 흰색, 무색 또는 색상 일 수 있습니다.
* 용해도 : 대부분의 소금은 물에 용해되지만 일부는 불용성입니다.
* 용융점 및 비등점 : 염은 일반적으로 유기 화합물에 비해 높은 용융 및 끓는점을 갖는다.
3. 화학 시험 :
* 전도도 : 용해 된 염은 유리 이온의 존재로 인해 전기를 전도합니다.
* pH : 염은 산과 기초의 강도에 따라 산성, 기본 또는 중성 일 수 있습니다.
* 강수 반응 : 특정 염은 다른 용액과의 반응으로 식별 될 수 있으며, 침전물의 형성으로 이어집니다.
4. 분광법 :
* 적외선 분광법 (IR) : 소금에 존재하는 기능 그룹을 식별 할 수 있습니다.
* 핵 자기 공명 (NMR) : 소금의 구조에 대한 정보를 제공합니다.
* X- 선 회절 : 소금의 결정 구조에 대한 자세한 정보를 제공합니다.
5. 기타 기술 :
* 적정 : 알려진 농도의 용액을 사용하여 알려지지 않은 염 용액의 농도를 결정할 수 있습니다.
* 화염 테스트 : 화염으로 소금을 가열하면 특징적인 색상이 생겨 식별을 도울 수 있습니다.
소금 식별의 예 :
* NaCl (염화나트륨) : 물에 용해 된 백색 결정질 고체는 용해 될 때 전기를 전도시킨다.
* cuso4 (구리 황산염) : 물에 용해 된 청색 결정질 고체는 용해 될 때 전기를 전도시킨다.
* CACO3 (탄산 칼슘) : 물에 불용성이없는 흰색 고체, 전기를 전도하지 않습니다.
기억하십시오 : 염분을 식별하려면 다른 방법의 조합이 필요하며 특정 기술은 이용 가능한 자원과 샘플의 특성에 따라 다릅니다.