주요 차이 - 산 VS 알칼리성
산과 알칼리성은 수생 화학에서 자주 발견되는 두 가지 용어입니다. 산은 산성 특성을 나타내는 화학 종입니다. 알칼리성은 기초 유형입니다. 따라서, 알칼리성 솔루션은 기본 특성을 보여줍니다. 산과 알칼리성의 주요 차이점은 입니다. 산의 pH는 pH 7 미만이지만 알칼리성의 pH는 pH 7 이상입니다. .
주요 영역을 다루었습니다
1. 산은
- 정의, 속성, 예
2. alkaline이란 무엇입니까
- 정의, 속성, 예
3. 산과 알칼리성의 차이는 무엇입니까
- 주요 차이점 비교
주요 용어 :산, 알칼리, 알칼리 지구 금속, 알칼리성, 수생 화학,베이스, 루이스 산, pH, 강산, 약산 
산
산은 염기에 의해 중화 될 수있는 화학 종입니다. 산은 수용액에서 양성자 또는 H 이온을 방출 할 수있다. 산은 그의 공액 염기 및 H 이온으로 분리 될 수있다. 해리 강도에 따르면 두 가지 유형의 산이 있습니다.
- 강산
- 약산
강산은 이온에 완전히 분리 할 수있는 화합물입니다. 약산은 부분적으로 이온에 분리되는 화합물이다. 따라서, 약산은 수용액에서 접합 된 염기 및 H 이온과 평형 상태이다.
산의 pH는 항상 7 미만입니다. pH 7은 순수한 물과 같은 용액의 중성 pH입니다. 매우 낮은 pH 값은 강산에 의해 주어지고 pH 7에 가까운 pH 값은 약산에 의해 주어진다. 그러나, 산은 수용액에 높은 양의 H 이온을 제공하고 pH는 H 농도 역의 역수이다.
.또한, 기증자로부터 전자 쌍을 받아 들일 수있는 화합물은 Lewis Acid 로 알려져 있습니다. . 이 정의에 따르면, H를 함유하지 않는 일부 화합물도 산으로 분류됩니다. 예를 들어, alcl 3 (알루미늄 트리클로라이드)는 루이스 산입니다. Al 원자에는 공여자로부터 들어오는 전자 쌍을 받아 들일 수있는 빈 P 궤도가 있기 때문입니다.
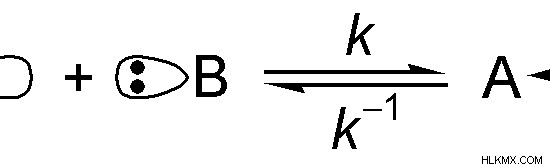
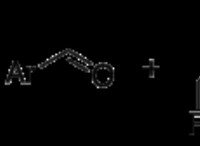
그림 01 :루이스 산과 루이스베이스 사이의 반응
위의 이미지에서“A”는 화학 화합물입니다. "B"의 고독한 전자 쌍을 허용 할 수 있습니다. 따라서“A”는 루이스 산입니다.
일반적으로 산은 신맛이 나는 시음이며 집중 형태로 부식성입니다. 파란색 리트머스를 붉은 색으로 바꿀 수 있습니다. 대부분의 산은 금속과 반응하여 소금 및 수소 가스를 형성 할 수 있습니다 (H 2 ).
alkaline
알칼리성은 7 이상의 pH 값을 갖는 솔루션입니다. 이는 알칼리성 솔루션이 기본 특성을 나타내는 것을 의미합니다. 따라서, 알칼리성 용액은 산에 의해 중화 될 수있다. 알칼리성 솔루션은 쓴 맛이 좋고 만질 때 미끄러 져 느껴집니다.
알칼리성 솔루션은 알칼리가 물에 용해 될 때 형성됩니다. 알칼리는 기본 수산화물 또는 알칼리 금속 또는 알칼리성 지구 금속의 염을 말합니다. 알칼리성이라는 용어는주기적인 요소 표에서 그룹 1 및 그룹 2의 금속 요소로부터 유래된다. Group1 요소를 알칼리 금속이라고합니다. 그룹 2 금속을 알칼리 지구 금속이라고합니다. 두 가지 유형의 금속은 물에 첨가 될 때 물의 pH가 증가하게됩니다. 즉, 알칼리 금속 또는 알칼리 지구 금속이 물에 첨가 될 때 물 분자와 반응하여 금속 수산화물 및 H 2 를 형성하기 때문입니다. 가스. 이 금속 수산화물은 오하이온의 농도가 증가함에 따라 용액의 pH가 증가하게됩니다.

그림 02 :알칼리 금속과 물인 나트륨 (NA) 사이의 반응 (H2O)
그 외에도 알칼리성 솔루션은 빨간색 리트머스를 파란색으로 바꿀 수 있습니다. 이것은 알칼리성 용액의 염기성을 나타내는 것입니다. 일부 알칼리성 솔루션은 부식성이지만 일부는 그렇지 않습니다. 모든 알칼리성 솔루션은 물에 용해 된 염기입니다. 그러나 일부 염기는 물에 용해되지 않기 때문에 모든 염기는 알칼리성이 아닙니다.
암모니아 (NH3)는 알칼리성으로 분류되지만 수산화물 또는 알칼리 금속의 소금은 아니지만 알칼리성으로 분류됩니다. 이것은 물에 매우 잘 용해되고 수용액이 기본 특성을 보여주기 때문입니다.
산과 알칼리성의 차이
정의
산 : 산은 pH가 7 미만인 화학 종입니다.
알칼리성 : 알칼리성 용액은 pH가 7 이상인 화학 물질입니다.
이온이 존재하는
산 : 산의 수용액은 H 이온으로 구성됩니다.
알칼리성 : 알칼리성의 수용액은 OH 이온으로 구성됩니다.
맛
산 : 산은 맛이 신맛이납니다.
알칼리성 : 알칼리성은 쓴 맛입니다.
텍스처
산 : 산은 끈적 끈적합니다.
알칼리성 : 알칼리성은 미끄러 져 있습니다.
중화
산 : 산은 염기에 의해 중화 될 수 있습니다.
알칼리성 : 알칼리성은 산에 의해 중화 될 수 있습니다.
결론
산과 알칼리성은 각각 pH 값이 낮고 높은 솔루션입니다. 산과 알칼리성의 주요 차이점은 산의 pH가 pH 7 미만이며 알칼리성의 pH는 pH 7을 초과한다는 것입니다. 이들은 물의 산도 및 알칼리도를 결정하는 데 매우 중요한 역할을합니다. 따라서 음주 및 기타 목적으로 수질을 확인하는 데 귀중한 매개 변수입니다.