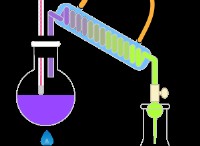
버퍼 시스템
* HF (Hydrofluoric acid) 약산입니다.
* NAF (불화 나트륨) 컨쥬 게이트베이스, F⁻ (플루오 라이드 이온)를 제공합니다.
강산 (예 :HCl) 첨가
1. 베이스와의 반응 : 강산 (HCl)은 완충액으로부터 불소 이온 (F⁻)과 반응하여 HF 및 클로라이드 이온 (CL⁻)을 형성한다.
```
h⁺ (aq) + f⁻ (aq) ⇌ hf (aq)
```
2. 평형 변화 : 이 반응은 일부 f 사이의 이온을 소비하여 평형이 오른쪽으로 이동하여 더 많은 HF의 형성에 유리합니다.
결과
* 최소화 된 pH 변화 : 강산의 첨가는 용액의 산도를 증가 시키지만, 완충 시스템은 pH의 변화를 최소화한다. 완충액은 첨가 된 HAT 이온을 소비하여 pH의 급격한 감소를 방지합니다.
중요한 메모
* 버퍼 용량 : 완충액의 효과는 약산 (HF)의 컨쥬 게이트 염기 (F⁻)의 비에 의존한다. 버퍼는 비율이 너무 불균형해질 때까지 첨가 된 산 또는 염기를 효과적으로 중화시킬 수 있습니다.
* 강산 대 강한 염기 : 이 버퍼 용액에 강한베이스를 추가하면 유사한 반응이 발생하지만 평형은 왼쪽으로 이동하여 HF를 소비하고 더 많은 이온을 형성합니다.
전체 방정식 (단순화) :
```
HCl (AQ) + NAF (AQ) ⇌ HF (AQ) + NACL (AQ)
```
이 단순화 된 방정식은 강산 (HCl)의 소비와 더 많은 약산 (HF)의 형성을 강조하는 전체 반응을 보여줍니다.