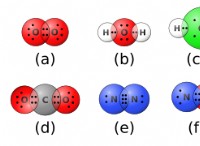
일반 원칙 :
* 보다 안정적인 전자 구성을 달성하기 위해 화학 결합이 형성됩니다. 원자는 전자의 외부 껍질을 가득 채우고 고귀한 가스를 모방하기 위해 노력합니다. 이것은 전자를 공유, 기증 또는 수용함으로써 달성 될 수 있습니다.
* 화학 결합의 강도는 관련된 원자의 유형과 공유 또는 전달 된 전자의 수에 따라 다릅니다. 더 강한 결합은 일반적으로 더 많은 공유 전자 또는 원자 사이의 전기 음성의 차이를 포함합니다.
* 화학적 결합은 모든 분자와 화합물의 형성을 담당합니다. 그들은 물질의 모양, 특성 및 반응성을 지시합니다.
채권의 유형 :
* 이온 결합은 한 원자에서 다른 원자로 전자를 완전히 전달하는 것을 포함합니다. 이는 정전기 인력에 의해 함께 유지되는 양의 및 음으로 하전 된 이온을 형성한다.
* 공유 결합은 두 원자 사이의 전자 공유를 포함합니다. 이들은 공유 전자의 수에 따라 단일, 이중 또는 삼중 결합 일 수 있습니다.
* 금속 결합은 전자가 전체 구조 전체에서 비편화되는 금속에서 발생합니다. 이것은 높은 전기 전도도와 가단성을 허용합니다.
* 수소 결합은 고도로 전기 음성 원자에 결합 된 수소 원자를 포함하는 특수한 유형의 쌍극자-디포 상호 작용이다. . 이러한 결합은 공유 결합보다 약하지만 생물학적 시스템에서 중요한 역할을합니다.
다른 중요한 고려 사항 :
* 극성 공유 결합은 전기성이 상이한 원자 사이에 형성됩니다. 공유 전자는보다 전기 음성 원자에 더 가깝게 당겨져 한 원자에 부분 양전하가 생성되고 다른 원자에는 부분적 음전하가 생성됩니다.
* 결합은 물질의 물리적 및 화학적 특성에 영향을 미칩니다. 예를 들어, 물질의 용융점, 끓는점 및 용해도는 존재하는 결합의 유형 및 강도에 의해 결정된다.
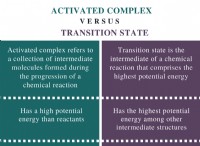
주목해야 할 중요 : 광대 한 화학적 결합 세계에는 많은 구체적인 예와 뉘앙스가 있습니다. 이 진술은 일반적인 개요를 제공하지만 완전한 이해를 위해서는 추가 탐색이 필요합니다.