이 기사에서는 화학의 결합 유형을 살펴 봅니다. 우리는 화학 결합이 무엇인지 설명하고 화학 결합의 유형을 나열하며 화학 결합 사례를 제공합니다. 결합은 화합물이 가지고있는 많은 화학적 특성을 지시하기 때문에 화학에서 매우 중요합니다.
화학적 결합
원자가 서로 끌어와 함께 분자를 형성 할 때, 우리는 각 원자 사이의 연결을 화학 결합 이라고 부릅니다. . 결합은 분자, 이온 또는 결정의 원자를“함께 유지”합니다. 채권은 종종 외부 힘이나 에너지에 의해 부서 질 때까지 무기한 지속될 수 있습니다.
화학적 결합은 안정적인 화학적 화합물을 형성 할 수있는 둘 이상의 원자 사이의 인력이다. 화학적 결합의 특정 특성은 다를 수 있지만 가장 일반적으로 알려진 것은 공유 및 이온 결합입니다. 이러한 결합을 사용하면 원자가 적을 때 충분한 에너지를 제공합니다. 원자가 고정되어 전자가 결합을 형성 할 수있는 것은 매력의 힘입니다.
1 차 및 2 차 결합
화학적 결합은 두 가지 유형 중 하나 일 수 있습니다. 1 차 및 2 차 결합. 1 차 결합에는 공유, 이온 성 및 금속 결합이 있습니다. 2 차 결합에는 수소 및 반 데르 발스 본드가 있습니다. 이러한 결합은 이온이나 전자 공유를 포함하지 않기 때문에 1 차 결합보다 약하고 장거리입니다.
화학 결합 유형
화학의 결합 유형은 무엇입니까? 공유 결합, 이온 결합 및 금속 결합의 세 가지 유형의 결합 유형을 살펴 보겠습니다.
공유 결합
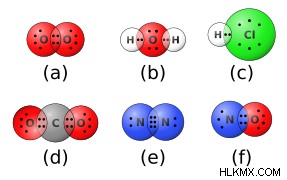
공유 결합 또는 분자 결합은 한 쌍의 전자를 공유하는 두 원자 사이에 형성된 화학적 결합이며; 이러한 유대를 형성하는 요소는 일반적으로 비금속입니다. O 2 와 같은 화합물에서 산소, 수소 및 질소의 일부 예. 및 H 2 영형). 공유 결합의 정의 특성은 전자 밀도가 결합의 중간에서 높다는 것입니다. 이는 전자가 양쪽 끝보다 두 원자 사이에서 발견 될 가능성이 높다는 것을 의미합니다. 화학자들은 때때로 분자 궤도 이론이라는 모델을 사용하여 공유 결합이 형성되는 방식을 설명하고 예측합니다.
다중 채권
공유 결합은 단일 또는 다중 결합 일 수 있습니다. 단일 결합에서, 두 원자 사이에 한 쌍의 원자가 전자 만 공유되고있다. 그러나 때때로 원자는 하나 이상의 전자 쌍을 공유하여 다중 결합이라고 불리는 것을 형성합니다. 다중 결합의 일반적인 유형은 이중 및 트리플이며, 고차 결합은 특정 이국적인 이국적인 화합물에서만 형성됩니다. 다중 결합에 가장 자주 참여하는 요소는 탄소, 질소, 산소, 인 및 유황입니다.
결합 극성
공유 화학 결합은 극성 또는 비극성 일 수 있습니다. 극성 공유 결합은 전자를 불평등하게 공유하는데, 이는 분포가 불균형이며 하나의 원자를 부분 음전하로, 다른 원자는 부분 양전하를 갖는 것을 의미합니다. 비극성 공유 결합은 두 원자를 가로 질러 전자를 동일하게 공유하여 균형 잡힌 분포를 초래하며 동일한 요소의 두 원자 사이에서만 실제로 형성 될 수 있습니다. 그러나, 때때로 화학자들은 원자들 사이의 전기 음성 성 차이를 사용하여 "대부분"비극성 공유 결합과 극성 공유 결합을 구별합니다. 전기 음성 차이가 약 0.4 단위 미만인 경우, 결합은 일반적으로 비극성으로 간주됩니다. 차이가 0.4 이상이면이 표준에 의해 결합이 극성입니다. 1.8 단위 이상의 차이로, 본드는 더 이상 공유되지 않지만 ionic (아래 참조).
이온 결합
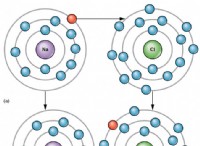
이 유형의 화학적 결합은 한 원자에서 다른 원자에서 다른 원자로 전자를 전달하는 것을 포함하며, 일반적으로 금속에서 비-금속으로 전자를 전달하는 것을 포함합니다 (예에는 NaCl 및 Li 2 가 포함됩니다. o).
- 이온 성 화합물은 전자가 공유되지 않지만보다 전기 음성 원자에 의해 공유되지 않기 때문에 완전한 양전하 및 음전하를 갖는다.
- 전자를 잃는 원자는 양전하가 있고 전자를 얻는 원자는 전자를 얻는 데 음전하가 있습니다.
금속 결합
금속 결합은 금속의 원자들 사이의 화학적 결합이다. 자유롭게 움직이는 전자의 바다와 유사하게, 이들 결합은 금속의 모든 원자를 한 번에 연결합니다 (공유 결합과 대조적으로 원자는 분자의 특정 부분에 분리 된 전자 쌍을 공유합니다). 이 화학적 결합은 광택 및 전기 및 열전도율을 포함하여 벌크 금속의 많은 특성을 담당합니다.
다른 기사의 화학 결합 주제
- 이온 성 대 공유 결합
- 수소 결합이란 무엇입니까
- 분자간 힘
- 이온 다이폴 세력은 설명했다
- 결합 형성 에너지
화학 결합 및 옥틴 규칙
원자는 핵에서 가장 멀리 떨어진 원자가 전자라고 불리는 전자를 가지고 있으며 화학 결합에 참여합니다. 이들 전자는 공유 또는 옥트 규칙을 달성하기 위해 공유 또는 전달되어야하며, 이는 원자가 안정성을 달성하기 위해 외부 쉘에 8 개의 전자를 가져야한다고 명시한다. 그러나이 규칙은 탄소 및 질소와 같은 주요 그룹 요소에만 적용됩니다.
붕소는 6 개의 전자를 갖는 것을 선호하기 때문에 BF3 또는 붕산 (H3BO3)과 같은 화합물을 형성하는 경우가 종종 있으므로 낙지 규칙에 주목할만한 예외입니다. 주기성 테이블의 세 번째 줄과 그 너머의 요소는 옥셋이 팽창 할 수 있으며, 이는 원자가 껍질에 8 개 이상의 전자를 가지고 있음을 의미합니다. 인, 황 및 요오드