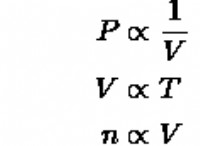이유는 다음과 같습니다.
* 전자 구성 : 할로겐은 가장 바깥 쪽 껍질에 7 개의 전자를 가지므로 안정적인 옥셋보다 1 개의 전자가 부족합니다.
* 전자 얻기 : 전체 외부 쉘을 달성하기 위해 하나의 전자를 얻는 경향이있어 -1 전하가 발생합니다.
그러나 할로겐은 특정 화합물에 따라 다른 산화 수를 나타낼 수 있다는 점에 유의해야합니다. 예를 들어 :
* 불소 : 항상 산화 수는 -1입니다.
* 염소 : -1에서 +7 범위의 산화 수를 가질 수 있습니다.
* Bromine : -1에서 +7 범위의 산화 수를 가질 수 있습니다.
* 요오드 : -1에서 +7 범위의 산화 수를 가질 수 있습니다.
* 아스타틴 : -1에서 +7 범위의 산화 수를 가질 수 있습니다.
따라서 -1은 할로겐의 가장 흔한 산화 수이지만 그 값에만 국한되지 않습니다.