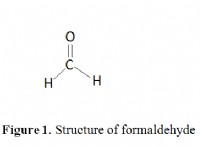
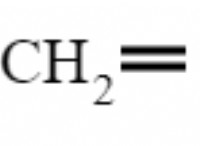화학 성분의 변화 :
* 새로운 물질의 형성 : 반응물 (시작 재료)은 화학적 특성이 다른 완전히 다른 제품으로 변환됩니다. 여기에는 화학적 결합의 파괴 및 형성이 포함됩니다.
* 원자의 재 배열 : 반응물 내의 원자는 새로운 분자를 형성하도록 재 배열된다.
* 산화 상태의 변화 : 원자는 산화 상태를 바꾸어 전자를 얻거나 잃을 수 있습니다.
에너지 변화 :
* 에너지 방출 (발열 반응) : 반응은 주변으로 열을 방출하여 종종 온도가 상승합니다.
* 에너지 흡수 (흡열 반응) : 반응은 주변 환경에서 열이 발생하여 종종 온도가 떨어집니다.
물리적 변화 :
* 색상 변화 : 물질의 외관은 크게 변할 수 있으며, 새로운 화합물이 형성되었음을 나타냅니다.
* 침전물의 형성 : 솔루션에서 견고한 제품이 형성됩니다.
* 가스의 진화 : 가스 거품은 환경으로 방출됩니다.
* 냄새 또는 맛의 변화 : 생성물은 반응물에 비해 뚜렷한 냄새 또는 취향을 가질 수 있습니다.
다른 현상 :
* 촉매 관련 : 촉매는 과정에서 소비되지 않고 반응 속도를 높이게합니다.
* 평형 : 순방향 및 역 반응의 속도가 동일하여 일정한 농도의 반응물 및 생성물을 초래하는 상태.
* 부작용 : 원치 않는 반응은 주요 반응과 함께 발생하여 바람직하지 않은 제품을 생산할 수 있습니다.
중요한 메모 :
* 화학 반응은 질량 보존 법에 의해 지배됩니다 : 반응물의 총 질량은 총 제품의 총 질량과 같아야합니다.
* 화학 방정식은 변화를 나타냅니다. 그들은 반응물과 생성물의 화학적 공식뿐만 아니라 각각의 화학량 론 (상대 양)을 보여줍니다.
이러한 측면을 이해하면 의학, 산업 및 일상 생활을 포함한 많은 분야에서 필수적인 화학 반응의 결과를 예측하고 제어 할 수 있습니다.