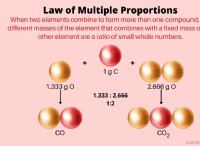
특성 :
* 빠른 반응 : 연소는 종종 에너지의 파열로 빠르게 발생합니다.
* 열과 빛 생산 : 반응은 상당한 열 (발열)을 방출하고 빛, 일반적으로 불꽃을 생성합니다.
* 산화제 : 가장 흔한 산화제는 산소 (O2)이지만 염소 나 불소와 같은 다른 물질도 사용할 수 있습니다.
* 연료 : 산화제와 반응하는 물질을 연료라고합니다. 단단한 (목재), 액체 (가솔린) 또는 기체 (메탄) 일 수 있습니다.
일반 공식 :
연료 + 산화제 → 제품 + 열 + 조명
예 :
전형적인 예는 공기 중에 메탄 (천연 가스)의 연소입니다.
CH4 (메탄) + 2 O2 (산소) → CO2 (이산화탄소) + 2 H2O (물) + 열 + 빛
시각적 표현 :
* 불꽃 : 당신은 종종 연소 반응의 눈에 띄는 부분 인 불꽃을 보게됩니다. 불꽃의 색상과 크기는 연료와 조건에 따라 다릅니다.
* 연기 : 일부 연소 반응은 미세 입자와 가스의 혼합물 인 연기를 생성합니다.
* 열 : 당신은 반응에 의해 방출 된 열을 느낄 수 있습니다.
중요한 메모 :
* 연소 반응은 발전, 난방 및 운송을 포함한 많은 프로세스에 필수적입니다.
* 불완전한 연소는 일산화탄소 (CO)와 같은 유해한 부산물을 생산할 수 있습니다.
* 연소 반응을 제어하는 것은 안전성과 효율에 중요합니다.
요약 : 연소 반응은 연료와 산화제, 일반적으로 산소와의 빠른 반응을 포함하는 열과 빛을 방출하는 활기차고 활력있는 과정입니다.