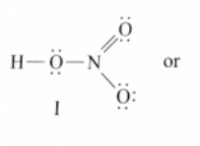
1. 균형 화학 방정식 :
에탄의 연소를위한 균형 잡힌 화학 방정식은 다음과 같습니다.
2 C2H6 + 7 O2 → 4 CO2 + 6 H2O
2. 반응물 제한 :
* 두더지 비율을 결정하십시오 : 방정식은 2 몰의 C2H6이 7 몰의 O2와 반응 함을 보여준다.
* 필요한 o2를 계산합니다 : 2 몰의 C2H6과 완전히 반응하려면 (7/2) * 2 =7 몰의 O2가 필요합니다.
* 제한 반응물을 식별하십시오 : 우리는 1.6 몰의 O2 만 있기 때문에 제한 반응물입니다. 모든 O2가 소비되면 반응이 중지됩니다.
3. 반응 소비 :
* o2 : 1.6 몰의 O2가 소비됩니다.
* C2H6 : 1.6 몰의 O2를 사용하려면 (2/7) * 1.6 =0.46 몰의 C2H6이 필요합니다.
4. 남아있는 반응물 :
* C2H6 : 우리는 2 몰로 시작하여 0.46 몰을 사용하여 2-0.46 = 1.54 몰의 C2H6 나머지 를 남겼습니다. .
결론 :
반응 후, 1.54 몰의 C2H6 가있을 것이다. 및 NO O2 남아 있습니다.