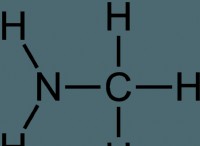
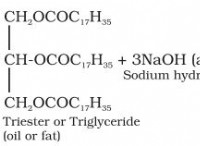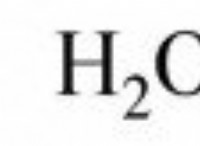열 방출 (발열 과정) :
* 용질 분자와 용매 분자 사이의 매력이 순수한 용질 및 용매 내의 힘보다 강할 때. 이것은 원래 물질을 분리하는 데 필요한 것보다 용액을 형성 할 때 더 많은 에너지가 방출된다는 것을 의미합니다. 이것은 부정적인 엔탈피 변화 (ΔH) 로 이어진다 , 열 방출을 나타냅니다.
* 예 : 염화나트륨 (NaCl)과 같은 소금을 물에 용해시키는 소금. 이온과 물 분자 사이의 강한 이온-쌍극자 상호 작용은 염의 이온 결합과 물의 수소 결합을 파괴하는 것보다 더 많은 에너지를 방출합니다.
열 흡수 (흡열 과정) :
* 용질 분자와 용매 분자 사이의 매력이 순수한 용질 및 용매 내의 힘보다 약하면. 이는 용액 형성 중에 방출되는 것보다 원래 물질의 기존 힘을 극복하기 위해 더 많은 에너지가 필요하다는 것을 의미합니다. 이로 인해 양성 엔탈피 변화 (ΔH) 가 발생합니다 , 열 흡수를 나타냅니다.
* 예 : 질산 암모늄 용해 (nh₄no₃). 이온 다이폴 상호 작용은 물의 수소 결합과 소금의 이온 결합보다 약합니다. 이를 위해서는 기존 결합을 깨뜨리려면 에너지가 필요하므로 열 흡수가 발생합니다.
열 변화에 영향을 미치는 요인 :
* 용질 및 용매의 특성 : 관련된 분자간 힘의 유형과 강도는 중요한 역할을합니다.
* 농도 : 용해 된 용액의 양은 전체 엔탈피 변화에 영향을 미칩니다.
* 온도 : 더 높은 온도는 일반적으로 흡열 과정을 촉진 할 수 있습니다.
요약 :
* 발열 : 더 강한 용질-용매 상호 작용으로 형성된 용액은 열을 방출합니다.
* 흡열 : 약한 용질-용매 상호 작용으로 형성된 용액은 열을 흡수합니다.
이들은 일반적인 추세이며 특정 사례는 관련된 물질 및 조건에 따라 분석해야합니다.