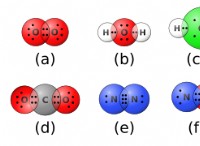
1. 요소와 그 숫자를 식별하십시오
* 공식으로 시작하십시오 : 예를 들어, NaCl을 가져 가자.
* 요소를 분해하십시오 : NaCl은 나트륨 (NA) 및 염소 (CL)를 함유한다.
* 원자를 계산하십시오 : 하나의 나트륨 원자 (NA)와 하나의 염소 원자 (CL)가 있습니다.
2. 기본 이름 지정 규칙
* 금속 비 금속 화합물 :
* 금속 (양이온)은 첫 번째로 선정되었습니다.
* 비금속 (음이온)은 두 번째로 지정되었으며 결말은 "-ide"로 변경되었습니다.
* 예 : NaCl은 염화나트륨입니다.
* 비금속-비 금속 화합물 (공유 화합물) :
*주기 테이블의 왼쪽에 더 이상 요소가 먼저 지정되었습니다.
* 동일한 그룹에있는 경우 테이블의 낮은 그룹은 첫 번째 이름입니다.
* 접두사는 각 요소의 원자 수를 나타내는 데 사용됩니다.
* mono- (1)
* di- (2)
* tri- (3)
* tetra- (4)
* 펜타- (5)
* hexa- (6)
* Hepta- (7)
* 옥타- (8)
* nona- (9)
* deca- (10)
* 두 번째 비금속의 결말은 "-ide"로 변경됩니다.
* 예 : 이산화탄소는 이산화탄소입니다.
3. 다 원자 이온 취급
* 다 원자 이온을 식별하십시오 : 이들은 전하 (예를 들어, 설페이트 (SO₄²⁻), 포스페이트 (po₄³⁻), 암모늄 (NH₄⁺))을 갖는 단일 단위로서 작용하는 원자 그룹이다.
* 다 원자 이온의 표준 이름을 사용하십시오 : 이것들을 암기해야합니다.
* 화합물에 따라 금속-비 금속 또는 비금속-비 금속 규칙을 따르십시오 :
* 예 : Na₂oas는 황산나트륨입니다 (나트륨은 금속이고 황산염은 다 원자 이온입니다).
4. 특별한 경우
* 전이 금속 : 종종 여러 번의 청구가 있습니다. 괄호 안의 로마 숫자는 금속의 전하를 나타내는 데 사용됩니다.
* 예 : fecl₂은 철 (II) 클로라이드입니다. Fecl₃은 철 (III) 클로라이드입니다.
* 산 : 이들은 수소와 비금속 또는 다 원자 이온을 함유한다.
* 이진산 : "Hydro-"로 시작하여 비금속 뿌리를 추가하고 "-ic acid"로 끝납니다.
* Oxoacids : 산소와 비금속을 함유합니다.
* 비금속의 산화 상태가 낮은 경우 이름은 "-우산"으로 끝납니다.
* 비금속의 산화 상태가 더 높은 경우 이름은 "-ic acid"로 끝납니다.
* 예 : HCl은 염산이다. hoyso₂는 황산입니다.
5. 자원 및 실습
* 주기 테이블 : 정기 테이블은 가장 친한 친구입니다! 요소 기호 및 위치에 대한 정보를 제공합니다.
* 명명기 차트 : 많은 차트와 테이블에는 일반적인 다 원자 이온과 충전이 나열됩니다.
* 연습 : 공식에서 명명 화합물을 연습합니다. 더 많이할수록 더 쉬워집니다.
더 많은 예를 원하거나 특정 유형의 화합물에 집중하고 싶다면 알려주십시오. 나는 당신이 배우도록 돕기 위해 여기에 있습니다!