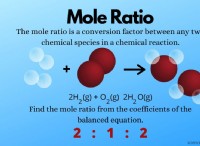
1. 분자는 더 빨리 움직입니다. 열의 주요 효과는 가스 분자의 운동 에너지를 증가시키는 것입니다. 이것은 그들이 더 빨리 움직이고 서로와 용기의 벽에 맞서고 있음을 의미합니다.
2. 압력 증가 : 분자가 더 빨리 움직일 때, 그들은 용기 벽과 더 자주 그리고 더 큰 힘으로 충돌합니다. 이 증가 된 힘은 용기 내부의 더 높은 압력으로 해석됩니다.
3. 볼륨이 증가 할 수 있습니다 (허용되는 경우) : 용기가 유연한 경우 (풍선과 같이) 가스의 압력과 부피를 수용 할 수 있도록 확장됩니다. 용기가 단단한 경우 (밀봉 된 병과 같은) 압력은 온도 증가에 비례하여 증가합니다.
4. 온도 상승 : 이것이 가장 명백한 효과입니다. 가스의 온도는 분자의 평균 운동 에너지를 직접 반영합니다. 가열은 운동 에너지를 증가시켜 온도를 높입니다.
이러한 변화에 관한 법률 :
* 찰스의 법칙 : 이 법은 가스의 부피가 압력이 일정하게 유지된다고 가정 할 때 절대 온도에 직접 비례한다고 말합니다.
* Gay-Lussac의 법칙 : 이 법은 가스의 압력이 부피가 일정하게 유지된다고 가정 할 때 절대 온도에 직접 비례한다고 말합니다.
* 이상적인 가스 법칙 : 이 법률은 Charles와 Gay-Lussac의 법칙을 결합하여 압력과 부피의 산물이 온도의 산물과 가스의 몰에 직접 비례한다고 진술합니다.
요약 : 용기에 가스를 가열하면 이동 분자가 더 빠르고 압력이 증가하며 부피가 증가하여 온도가 상승합니다.