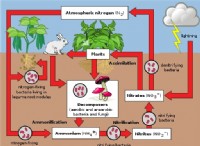
이유는 다음과 같습니다.
* 전자 친화력 전자가 기체 상태의 중성 원자에 첨가 될 때 에너지의 변화입니다. 보다 음의 전자 친화력 값은 전자를 얻는 경향이 더 크다는 것을 나타냅니다.
* 불소 (f) 전자 친화력이 높은 가 있습니다 질소 (N)보다. 이것은 다음과 같습니다.
* 작은 원자 크기 : 불소는 질소보다 작으며, 이는 들어오는 전자가 핵에 더 강하게 끌린다는 것을 의미합니다.
* 더 높은 전기 음성 : 불소는 질소보다 전기성이 높기 때문에 전자를 유치하는 경향이 더 높습니다.
* 반으로 가득 찬 p- 궤도 : 질소는 반 채로 된 p- 궤도를 가지고있어 더 안정적입니다. 전자를 추가하면 이러한 안정성이 방해되어 덜 유리합니다.
따라서, 불소는 질소보다 전자를 얻는 경향이 더 강해서 더 음의 전자 친 화성 값을 초래한다.