헬륨 (HE)
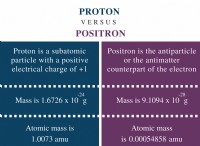
* 원자 구조 : 헬륨은 핵에 2 개의 양성자와 2 개의 중성자 만 가지므로 가장 가벼운 요소가됩니다.
* 화학 반응성 : 헬륨은 고귀한 가스이며, 이는 매우 반응하지 않으며 다른 요소와 쉽게 화학적 결합을 형성하지 않습니다.
* 물리적 특성 :
* 무색, 무취, 맛이없는 : 육안으로는 보이지 않습니다.
* 매우 저밀도 : 헬륨은 수소 이후 두 번째로 밀도가 높은 원소이며 부력이됩니다.
* 매우 낮은 끓는점 : -268.9 ° C (-452.0 ° F), 실온에서 가스가됩니다.
* 우수한 열전도율 : 매우 효율적으로 열을 전달합니다.
* 사용 :
* 풍선 및 비행선 : 부력은 물체를 들어 올리는 데 이상적입니다.
* 심해 다이빙 : 감압 질병을 예방하기 위해 호흡 혼합물에 사용됩니다 ( "벤드").
* 의료 응용 프로그램 : MRI 기계에 사용되고 초전도 자석을 식히는 데 사용됩니다.
* 용접 및 절단 : 고온 과정을위한 불활성 대기를 제공합니다.
산소 (O2)
* 원자 구조 : 산소는 핵에 8 개의 양성자와 8 개의 중성자가 있습니다. 2 개의 산소 원자는 함께 결합하여 규조토 분자 O2를 형성한다.
* 화학 반응성 : 산소는 반응성이 높고 연소 (연소)의 핵심 구성 요소입니다. 대부분의 살아있는 유기체에서 호흡에 필수적입니다.
* 물리적 특성 :
* 무색, 무취, 맛이없는 : 헬륨처럼 육안으로는 보이지 않습니다.
* 밀도 : 헬륨보다 밀도가 높습니다.
* 끓는점 : -183 ° C (-297 ° F), 실온에서 가스가됩니다.
* 연소 기능 : 산소는 화재의 핵심 성분입니다.
* 사용 :
* 호흡 : 모든 살아있는 유기체 (혐기성 박테리아 제외)는 생존하기 위해 산소가 필요합니다.
* 의료 응용 프로그램 : 호흡기 문제가있는 환자를 위해 병원에서 사용됩니다.
* 산업 공정 : 철강 생산과 같은 많은 산업 공정에 필수적입니다.
* 로켓 연료 : 액체 로켓 엔진에서 산화제로 사용됩니다.
주요 차이점 :
* 반응성 : 헬륨은 불활성이고 산소는 반응성이 높습니다.
* 밀도 : 헬륨은 산소보다 훨씬 덜 조밀합니다.
* 응용 프로그램 : 헬륨은 부력과 냉각에 사용되며 산소는 생명과 연소에 필수적입니다.
요약하면, 헬륨과 산소는 고유 한 특성과 응용 분야를 갖는 매우 다른 가스입니다. 헬륨의 밀도와 불활성은 들어 올리고 냉각하는 데 유용하지만 산소의 반응성은 생명과 산업 과정에 필수적입니다.