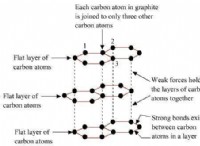
1. 원자 번호를 결정하십시오 :
* 탄소의 원자 수는 6이므로 6 개의 양성자와 6 개의 전자가 있습니다.
2. Aufbau 원리를 사용하십시오 :
* Aufbau 원리는 전자가 에너지를 증가시키기 위해 궤도를 채 웁니다.
* 궤도를 채우는 순서는 1, 2s, 2p, 3s, 3p, 4s, 3d, 4p 등입니다.
3. 궤도를 채우십시오 :
* 1s : 첫 번째 궤도는 2 개의 전자를 담을 수 있으므로 2 개의 전자 (1S²)로 채우십시오.
* 2s : 두 번째 궤도는 또한 2 개의 전자 (2S²)를 담을 수 있습니다.
* 2p : 2p sublevel에는 총 6 개의 전자에 대해 각각 2 개의 전자를 유지하는 3 개의 궤도가 있습니다. 탄소에는 4 개의 전자가 남아 있으므로 2p sublevel에 4 개의 전자 (2p⁴)를 채우십시오.
4. 전체 전자 구성을 작성하십시오 :
* 탄소의 전자 구성은 다음과 같습니다
중요한 참고 : 2p⁴ 표기법은 2p sublevel을 표현하는 단순화 된 방법입니다. 1s² 2s² 2p x 로 작성하는 것이 더 정확합니다. ² 2p y ¹ 2p z ¹ 이것은 3 개의 2p 궤도를 채우는 개별 전자를 보여줍니다.
다른 요소에 대한 전자 구성을 찾으려면 알려주십시오!