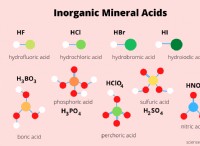
* 전방 반응 :
* 2H 2 (g) + o₂ (g) → 2h₂o (l)
* 이것은 산소 가스와 수소 가스의 연소로 액체 물을 생산합니다. 이것은 발열 반응으로 열을 방출한다는 것을 의미합니다.
* 역 반응 :
* 2h 2o (l) → 2h₂ (g) + o₂ (g)
* 이것은 수분의 전기 분해로, 전류가 물을 통과하여 구성 가스, 수소 및 산소로 분해됩니다. 이것은 흡열 반응으로 열이 필요하다는 것을 의미합니다.
여기에 이것이 가역적 인 반응 인 이유는 다음과 같습니다.
* 전방 반응의 생성물은 역 반응의 반응물이며 그 반대도 마찬가지입니다.
* 반응은 적절한 조건 하에서 어느 방향 으로든 진행할 수 있습니다. 예를 들어, 스파크가있을 때, 수소와 산소는 물을 형성하는 반면, 물을 통해 전류를 통과하면 수소와 산소로 분해됩니다.
가역적 화학적 변화의 다른 예로는 다음과 같습니다.
* 물에 소금을 용해시키는 물 (정방향 반응) 및 물을 증발하여 소금을 회수합니다 (역 반응)
* 에스테르의 형성 에스테르의 (전방 반응) 및 가수 분해 (역 반응)
* 암모니아를 형성하기위한 질소와 수소 사이의 반응 (전방 반응) 및 질소 및 수소를 형성하기위한 암모니아의 분해 (역 반응)
이러한 반응은 종종 이중 화살표를 사용하여 표현되며, 이는 반응이 양방향으로 진행될 수 있음을 나타냅니다.