CO2 (이산화탄소)
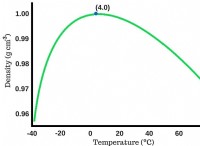
* 약한 분자간 힘 : CO2는 분자를 함께 잡고있는 반 데르 발스 힘이 약한 선형 분자이다. 이 힘은 저온에서 쉽게 극복되어 CO2가 고체에서 가스로 직접 숭고 할 수 있습니다.
* 비극성 분자 : CO2의 대칭 구조는 비극성 분자를 초래하여 분자간 상호 작용을 추가로 약화시킨다.
* 저 분자량 : CO2는 분자량이 상대적으로 낮으며, 분자간 관광 명소가 약해집니다.
SIO2 (실리콘 이산화 실리콘)
* 강한 공유 결합 : 실리콘은 거대한 공유 구조를 형성하며, 네트워크에서 실리콘 및 산소 원자를 함께 유지하는 강한 공유 결합이 있습니다. 이 본드는 고온을 파괴해야합니다.
* 높은 용융점 : 강한 공유 결합으로 인해 SiO2는 매우 높은 융점을 갖습니다.
* 3-D 네트워크 구조 : 실리콘 및 산소 원자의 사면체 배열은 3 차원 네트워크 구조를 생성하여 높은 안정성과 강성을 제공합니다.
요약 :
CO2는 약한 분자간 힘, 저 분자량 및 비극성 구조를 가지므로 저온에서 쉽게 숭고 할 수 있습니다. 반면에 SIO2는 강한 공유 결합, 거대한 네트워크 구조 및 고 분자량을 가지므로 매우 높은 용융점이 생깁니다.